Рассматриваются Римские диагностические критерии синдрома раздраженного кишечника (СРК) III. Обсуждаются принципы классификации СРК, представлены данные о его эпидемиологии и патофизиологических аспектах. С позиций доказательной медицины рассматриваются современные подходы к терапии СРК. Подчеркивается, что спазмолитики были и остаются основой лечения СРК. Их назначение целесообразно с позиций не только купирования спастических реакций кишечника, но и воздействия на висцеральную гиперчувствительность как одно из основных патогенетических звеньев синдрома посредством уменьшения чувствительности ноцицепторов.
С начале 1990-х гг. была предложена рейтинговая система оценки клинических
исследований, где с возрастанием порядкового номера доказательности качество клинических исследовний снижается. Уровни доказательности принято обозначать римскими цифрами, а градации рекомендаций –буквами латинского алфавита (табл. 1). Так, в медицину стали внедряться принципы доказательной медицины (evidence-based medicine) — подход к медицинской практике, при котором решения о применении профилактических, диагностических и лечебных мероприятий принимаются исходя из имеющихся доказательств их эффективности и безопасности, причем такие доказательства изыскиваются, сравниваются, обобщаются и широко распространяются для использования в интересах больных (Evidence Based Medicine Working Group, 1993).
В 2006 г. появились Римские диагностические критерии синдрома раздраженного кишечника (СРК) III. В отличие от первого документа, посвященного этой проблеме (1989), помимо СРК они включают диагностические критерии и для других функциональных заболеваний кишечника [7]:
С. Функциональные расстройства кишечника:
C1. Синдром раздраженного кишечника.
C2. Функциональное вздутие.
C3. Функциональный запор.
С4. Функциональная диарея.
C5. Неспецифическое функциональное кишечное расстройство.
Определение, принципы классификации и критерии постановки диагноза
В настоящее время общепринята т. н. биопсихосоциальная концепция патогенеза СРК. Ее реализация в видеклинических функциональных гастроинтестинальных расстройств складывается из тесной взаимосвязи психосоциальных и физиологических факторов, гастроинтестинальных симптомов и в итоге – формирования совокупной клинической картины.
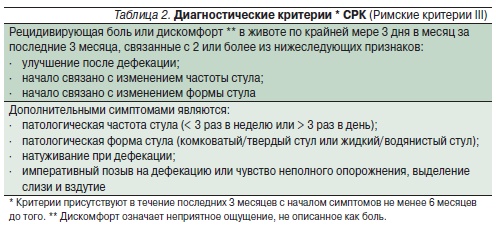
СРК – функциональное расстройство кишечника, при котором боль или дискомфорт в животе связаны с дефекацией, изменениями частоты и характера стула или другими признаками нарушения опорожнения кишечника. Чтобы отличать эти расстройства, носящие хронический характер, от преходящих нарушений со стороны желудочно-кишечного тракта, они должны встречаться в течение не менее 6 месяцев и проявляться не менее 3 дней в месяц в течение последних 3 месяцев (табл. 2). Это обоснованно позволяет использовать время на дифференциальную диагностику и обследование, а также указывает на текущую активность процесса. Поскольку облегчение боли или дискомфорта в связи с дефекацией может быть неполным, в англоязычной литературе термин “облегчение” после дефекации предложено заменять на “улучшение”. Предыдущие диагностические критерии предполагали отсутствие какихлибо структурных или биохимических отклонений. Однако весьма вероятно, что обследование по поводу последних может выявить как находку какое-либо функциональное заболевание кишечника.
Определение СРК составлено из набора характерных элементов и содержит критерии включения и исключения. Наиболее важно, что определение подчинено непрерывной адаптации клинической практики к результатам новых исследований, соответствует переосмыслению и тенденциям в
понимании этого заболевания. СРК является наиболее распространенной и изученной функциональной патологией. Несмотря на это, синдром остается малопонятным состоянием: пациенты испытывают боли и расстройство дефекации по необъяснимым до сих пор причинам.
После установки соответствия симптомокомплекса диагностическим критериям СРК необходимо классифицировать пациента по преобладающему симптому, чтобы в дальнейшем правильно определить лечебную тактику. Однако здесь, как это и было прежде, можно столкнуться с трудностями интерпретации жалоб больного. Стул может быть твердым, а дефекации – частые, т. н. псевдодиарея [17]. Наоборот, необходимость натуживания при дефекации может встречаться при мягком или водянистом кале.
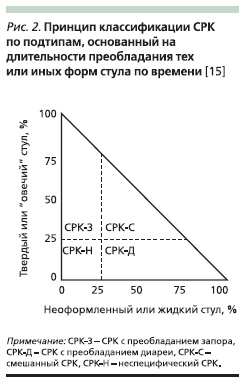
Согласно общепризнанным представлениям, закрепленным в Римских критериях III, при постановке диагноза и разделении больных на типы СРК клиницисты должны руководствоваться Бристольской шкалой формы стула (рис. 1) и использовать типы 1 и 2 формы стула для идентификации запора и типы 6 и 7 – для идентификации диареи [10].
Таким образом, на основе указанного выше принципа в последних рекомендациях предложено классифицировать всех больных с СРК на следующие типы: СРК с преобладанием запора, СРК с преобладанием диареи, смешанный СРК и неспецифический СРК. Главное условие при этом – учесть, не принимает ли больной какие-либо антидиарейные или слабительные средства. Из-за характерной неустойчивости и непостоянства симптомов, как и прежде, предпочтительно термины “СРК с запором” или “СРК с диареей” заменять на “СРК с преобладанием запора” и “СРК с преобладанием диареи”.
Принцип описанной выше классификации представлен на рис. 1, наглядно демонстрирующем 4 типа СРК в зависимости от текущих особенностей стула, из которого следует, что пациенты без диареи или запора отнесены к неспецифическому СРК (unsubtyped IBS). В некоторых исследованиях больные с запором и диареей определялись в группу смешанного СРК (mixed IBS) [8], в других работах подобные пациенты относились к группе альтернирующего или чередующегося СРК (alternating IBS) [10]. Некоторые авторы предлагают считать эти термины синонимами [16]. В Римских рекомендациях III под термином “альтернирующий СРК” предложено подразумевать пациентов, у которых форма стула
меняется очень часто.
Данная классификация действительно упрощает задачу практических врачей и исследователей при установлении типа СРК. Однако нельзя забывать о характерной изменчивости симптоматики синдрома. Так, продолжительность симптомов может составлять от нескольких минут до нескольких дней.
В настоящее время недостаточно данных, позволяющих установить определенный период времени, характерный для альтернирующего СРК, поэтому пока за основу его определения приняли только частую смену симптомов. В среднем в популяции среди больных СРК распространенность типов с преобладанием диареи, запора и смешанного примерно равна и составляет 33 %. У 75 % этих больных типы меняются, причем у 29 % приблизительно в течение года преобладание диареи сменяется преобладанием запора [8]. По данным других авторов, самый частый вариант синдрома – это смешанный СРК [10].
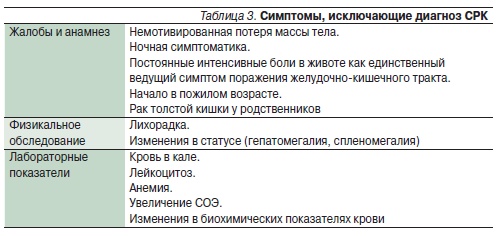
Именно поэтому и в клинической практике, и в исследовательской работе при лечении больных СРК до сих пор неизменной остается рекомендация полагаться на преобладающий в клинической картине симптом. Кроме того, при постановке диагноза СРК обязательно должны быть исключены симптомы “тревоги”, или т. н. красные флаги, представленные в табл. 3.
Эпидемиология СРК
Данные о распространенности СРК базируются в основном на больших исследованиях, проведенных в США и Великобритании, в то время как данные из развивающихся стран остаются малорепрезентативными. При сравнении данных эпидемиологических исследований разных стран
мира обнаруживаются явные различия. Распространенность СРК также широко варьируется в различных популяциях в пределах одной страны [1, 11, 20]. До конца не известно, чем вызваны эти различия: расой, социально-экономическим статусом, уровнем развития страны, различной трактовкой определения СРК или используемой методикой?
Опубликованные данные позволяют предположить, что заболеваемость СРК в среднем составляет 1 % в год.
Симптомы СРК распространены во всех возрастных группах, начало симптомов обычно происходит в молодом возрасте [13, 23]. Средний возраст больных СРК составляет 24–41 год. По данным одного национального исследования, в США распространенность симптомов СРК понижается после достижения среднего возраста. Симптомы СРК во всем мире имеют бóльшую распространенность среди женщин, соотношение мужчин и женщин среди больных составляет приблизительно 1 : 2. Этот факт отмечен независимо от используемых диагностических критериев [23].
Патофизиологические аспекты формирования и взаимосвязи
боли и моторных нарушений у больных СРК
Международной ассоциацией по изучению боли (IASP) дано следующее ее определение: боль – это неприятное ощущение и эмоциональное переживание, связанное с действительным или возможным повреждением тканей или описываемое в терминах данного повреждения. Иными словами, боль есть важнейший сигнал о повреждении тканей, поступающий в центральную нервную систему, и постоянно действующий регулятор гомеостатических реакций. Важно подчеркнуть, что боль – ощущение спонтанное, оно отличается от понятия “болезненность”, которая возникает при провоцирующем внешнем воздействии, например пальпации.
Несмотря на значительные достижения в клинической медицине в последние годы, решение вопроса об обоснованности диагностического поиска причин боли и их оптимального устранения представляет существенные трудности. Выделение синдрома функциональной абдоминальной боли в обособленную категорию D в Классификации функциональных гастроинтестинальных расстройств указывает на то, что далеко не все понятно в вопросе патофизиологии формирования боли. И в резюме всех опубликованных на сегодняшний день официальных рекомендаций отдельным пунктом звучит необходимость дальнейших исследований, посвященных этой проблеме.
В клинической гастроэнтерологии СРК является классическим примером популяционно значимого заболевания с психосоматической детерминацией, которое, как правило, сопровождается стойкими проявлениями абдоминальной боли. И как считалось до недавнего времени, характерной чертой СРК является отсутствие объективных биохимических и патоморфологических маркеров, позволяющих объяснить весь присущий этому синдрому симптомокомплекс.
Патофизиологические аспекты проведения болевого импульса у больных СРК изучены недостаточно; можно утверждать, что исследованы лишь отдельные его фрагменты. В связи с этим становится понятной относительно низкая эффективность лечения болевого синдрома у этой категории больных.
Согласно имеющимся в настоящее время представлениям, у пациентов, страдающих СРК, присутствуют объективные причины для формирования боли и нарушения двигательной функции кишечника; в частности, предполагается роль некоторых медиаторов.
Например, определено, что у больных СРК с преобладанием в клинической картине диареи количество энтерохромаффинных клеток превышает нормальную величину, но остается не вполне ясным, существует ли прямая зависимость между количеством энтерохромаффинных клеток и содержанием серотонина в кишке? По результатам одних исследований увеличение количества энтерохромаффинных клеток пропорционально увеличению количества серотонина, по мнению других авторов, такой корреляции нет. Как известно, выделившийся серотонин вызывает усиление моторики. При исследовании биоптатов кишки у пациентов с постинфекционной формой СРК без видимых признаков колита удалось выявить количественное увеличение уровня фактора роста нервов, что могло приводить к возникновению области гиперчувствительности в тканях, окружающих поврежденный участок, и к усилению как болевых, так и неболевых сигналов из примыкающих здоровых тканей.
Но является ли усиленная моториканепосредственной причиной возникновения боли?
Расстройства моторной активности описаны при различных вариантах СРК, однако их роль в формировании симптомов в большинстве случаев не доказана. Сильные эмоциональные и внешние стрессовые факторы и у здоровых людей вызывают усиление моторики пищевода, желудка, тонкой
и толстой кишки. Однако показано, что у пациентов с функциональными гастроинтестинальными расстройствами ответ на стресс (психологический или физиологический) в виде гипермоторики значительно превышает таковой у здоровых субъектов [6, 15]. Этот моторный ответ в целом коррелирует с некоторыми желудочно-кишечными симптомами, особенно диареей, запором и рвотой, однако никак не объясняет наличия хронической или рецидивирующей боли.
К биологическим изменениям, выявленным у больных СРК, можно отнести нарушение цитокинового баланса в сторону увеличения выработки провоспалительных и снижения продукции противовоспалительных цитокинов, возрастание количества энтерохромафинных клеток [2], а
также изменение содержания нейротрансмиттеров в синапсах проводящих путей болевого импульса.
К наиболее уязвимым локусам на пути следования сингала от кишки к головному мозгу и обратно относится задний рог спинного мозга. Импульсы от кишки приходят к спинномозговому ганглию, откуда центральные аксоны направляются через задние корешки в задний рог спинного мозга. Основными нейропереносчиками в проводящих путях, по которым идет болевой импульс, являются такие аминокислоты, как глутамат и аcпартат, нуклеотид аденозинтрифосфат и, возможно, двуокись азота [12]. Нару-шения синтеза и распада нейропереносчиков, а также конфигурации рецепторов могут быть ответственными за искажение болевого импульса, следующего от кишки к головному мозгу. Субстанция Р, обнаруженная в 1931 г. von Euler и John H. Gaddum и содержащаяся в нисходящих вставочных нейронах мезентерального сплетения, возбуждающих мотонейроны продольных и циркулярных мышц, также принимает участие в передаче ноцицептивных импульсов по афферентным волокнам нервных путей. Ее повышенное содержание в задних рогах приводит к усилению периферической сенситизации. Кроме того, у пациентов, страдающих СРК, отмечается нарушение функционирования антиноцицептивной системы, в частности снижение выработки эндогенных опиатов.
При этом у больных СРК может быть нарушен и процесс нисходящего (т. е. обусловленного влиянием коры головного мозга) подавления восприятия боли. Восприятие боли тесно связано с изменением эмоциональной модуляции афферентных сигналов и недостаточностью кортикальной активации системы, ингибирующей боль, и согласуется с классической теорией боли, согласно которой сенсорный и аффективно-когнитивный компоненты играют важную роль в ее ощущении. При детальном исследовании влияния перенесенного эмоционального стресса оказалось, что его действие опосредуется через изменения, происходящие в рецепторном аппарате структур головного мозга. В частности, снижается количество глюкокортикоидных рецепторов в гипоталамусе, гиппокампе и фронтальной части коры головного мозга, уменьшается количество ингибиторных пресинаптических α2-адренергических рецепторов в locus coeruleus. Поскольку locus coeruleus тесно взаимосвязан с кортиколиберин-секретирующими нейронами, изменение количества α2-адренергических рецепторов может приводить к нарушениям в функционировании гипоталамо-питуитарноадреналовой системы и как следствие – восприятия боли. Следствием стресса, перенесенного в раннем возрасте, является также нарушение в серотонинергической системе в виде снижения чувствительности ингибиторных пресинаптических 5-HT1A-рецепторов фронтальной части коры, ответственных за снижение чувствительности к растяжению кишки. Имеются сообщения о том, что при патологических состояниях хронического стресса (а как известно, такие состояния у больных СРК встречаются достоверно чаще, чем в популяции в целом) возможно нарушение стимуляции locus coeruleus, ингибирующего ноцицептивные ответы в нейронах задних рогов.
Ряд авторов объясняют развитие абдоминальной боли у больных СРК наличием у них висцеральной гипералгезии, которая может проявляться в виде не только снижения порога восприятия боли, но и более интенсивного ощущения боли. В свою очередь висцеральная гиперчувствительность часто формируется в результате т. н. сенсибилизирующих факторов (например, перенесенной кишечной инфекции, психоэмоционального стресса, физической травмы и др.). Повторяющиеся стрессы, с одной стороны, сопровождаются моторными расстройствами кишечника, с другой – на фоне повышенной рецепторной реакции в кишечнике вырабатываются афферентные стимулы, достигающие по чревному и блуждающему нервам центральных подкорковых и корковых отделов ЦНС и приводящие в дальнейшем к развитию феномена спинальной гипервозбудимости, когда обычные по силе раздражители (например, растяжение кишечника небольшим количеством газа) вызывают усиленный болевой ответ; формируется порочный круг, в котором стимуляция кишечных рецепторов, имеющих сниженный порог чувствительности, приводит к возникновению боли, вызывающей в свою очередь развитие стресса, способствующего высвобождению адреналина и энкефалинов в надпочечниках, которые обусловливают дальнейшую сенситизацию (снижение порога чувствительности) рецепторов и продолжение ощущения боли.
Таким образом, в основе патологического процесса при СРК лежат дисфункционально-дисрегуляторные нарушения, которые наблюдаются в корковых и подкорковых центрах, вегетативной нервной системе, периферическом нейрорецепторном аппарате кишечника с системой нейротрансмиттеров и биологически активных веществ (энтеральная нервная система).
Лечение СРК
Лечение больных СРК всегда было трудной задачей. Это связано с многообразием факторов, приводящих к развитию заболевания, часто возникающими расстройствами психоэмоциональной сферы, изменчивостью клинических проявлений, наличием в большинстве случаев сопутствующих заболеваний органов пищеварения, что вызывает необходимость одновременного назначения нескольких лекарственных препаратов. В свою очередь фармакотерапевтические средства, применяющиеся в лечении синдрома, могут вызывать побочные реакции.
Непрекращающиеся до настоящего времени попытки разработать эффективную схему терапии СРК с пролонгированным действием пока не дали результатов ни для одного варианта течения заболевания. Связано это с тем, что проблема поиска и объективной оценки эффективности того или иного препарата существенно усложняется из-за малоизученности патофизиологии СРК, отсутствии биологического маркера и достаточно выраженного эффекта плацебо в этой группе пациентов.
Таблица 4.
Препараты для возможного купирования преобладающего симптома СРК a, согласно данным Римского консенсуса III [15].
Общей рекомендацией является назначение лекарственной терапии с учетом преобладания у больных СРК тех или иных клинических симптомов (табл. 4). Сразу необходимо отметить, что на сегодняшний день фармакологические препараты не являются универсально эффективными: часто помогая одним больным, они оказываются неэффективными для других. При СРК препараты различных групп могут использоваться постоянно или по необходимости, в последнем случае это рекомендуется пациентам с периодически возникающими симптомами или различной их интенсивностью. Для рефрактерных к лечению больных возможно сочетание препаратов с различным механизмом действия.
Спазмолитическая терапия СРК
Итак, исходя из диагностических критериев СРК, абдоминальная боль и дискомфорт – кардинальные его симптомы, происхождение которых традиционно приписывают в т. ч. и спазму гладкомышечной стенки кишечника. И хотя данные по изучению этого вопроса остаются противоречивыми, многочисленные публикации и клинические исследования подтверждают, что чрезмерный ответ моторики тонкой и ободочной кишки на внешниестимулы ассоциирован с проявлением боли и дискомфорта при СРК [4–6, 9].
Группа спазмолитиков включает несколько различных по своему механизму действий классов препаратов – антимускариновые срества, гладкомышечные миорелаксанты, антихолинергические средства, а также такие уникальные в своем роде лекарственные вещества, как пинаверия бромид – селективный блокатор кальциевых каналов, и тримебутин – периферический агонист опиатных рецепторов [21].
Применение антихолинергических препаратов с учетом их механизма действия возможно при вариантах СРК с преобладанием болевого синдрома в сочетании с нарушением дефекации – в большей степени с диареей. Однако такие общие для этой группы лекарств побочные эффекты, как сухость во рту, головокружение, нарушение зрения, задержка мочеиспускания, центральные эффекты (особенно у пожилых), существенно ограничивают их использование в клинической практике, а с учетом высокого риска развития запора и вовсе делают их назначение при СРК с преобладанием запоров нецелесообразным [14, 18].
Из-за недостачного количества международных высококачественных исследований, посвященных изучению специфических спазмолитиков, оценить эффективность применения препаратов этого класса при СРК возможно, используя систематические обзоры и мета-анализы. Специальная комиссия Американской коллегии гастроэнтерологов изучила этот вопрос, подвергнув анализу 22 клинических исследования. Было выявлено, что в целом каждое исследование содержало достаточно большое количество методологических ошибок в отношении используемых диагностических критериев, критериев включения, режима дозирования лекарственных препаратов и длительности терапии, оценки конечных точек. Кроме того, только 3 исследования включало более 100 пациентов. С учетом этих ограничений анализу были подвергнуты данные 1778 пациентов с СРК. Обобщение результатов показало, что коэффициент риска неэффективности спазмолитиков по сравнению с плацебо составил 0,68 (95 % доверительный интервал [ДИ] – 0,57–0,81), а показатель NNT (число пациентов, которых необходимо пролечить, чтобы получить эффект у одного из них) равнялся 5. При оценке риска развития нежелательных явлений при приеме спазмолитиков было выявлено, что они наблюдались у 1379 больных. С учетом значительной гетерогенности этой группы пациентов коэффициент риска развития побочных эффектов составил 1,62 (95 % ДИ – 1,05–2,50), а показатель NNT – 18 (95 %
ДИ – 7–217).
Опубликовав в 2009 г. результаты мета-анализа, специальная комиссия сделала следующий вывод: “некоторые спазмолитики (гиосцин, циметропий и пинаверия бромид) могут обеспечить кратковременный эффект в отношении купирования боли или дискомфорта при СРК (уровень доказательности 2С), доказательств длительной эффективности нет (уровень доказательности 2В), доказательства безопасности и переносимости ограничены (уровень доказательности 2С)” [3].
Подобные выводы прозвучали и в Кокрейновском систематическом обзоре, опубликованном в 2011 г., в котором на основании изучения данных метаанализов сравнивалась эффективность использования различных представителей группы спазмолитиков с плацебо [19]. Главными критериями были влияние препаратов на абдоминальную боль и улучшение общего состояния. В итоге пинаверия бромид подтвердил свою эффективность и в том и в другом случае [3, 19]. В России пинаверия бромид зарегистрирован под торговым названием “Дицетел ®” и в дозировке 100 мг 2 раза в день призван помогать пациентам с СРК для купирования проявлений висцеральной гиперчувствительности.
Таким образом, спазмолитики были и остаются основой терапии СРК. Более того, их назначение целесообразно с позиций не только купирования спастических реакций кишечника, но и воздействия на висцеральную гиперчувствительность как одно из основных патогенетических звеньев синдрома посредством уменьшения чувствительности ноцицепторов.
Маев Игорь Вениаминович – член-корр. РАМН, доктор медицинских наук, профессор, заведующий кафедрой пропедевтики внутренних болезней и гастроэнтерологии лечебного факультета МГМСУ.
Черемушкин Сергей Викторович – кандидат медицинских наук, ассистент кафедры пропедевтики внутренних болезней и гастроэнтерологии лечебного факультета МГМСУ.
Кучерявый Юрий Александрович – кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней и гастроэнтерологии ГОУ ВПО МГМСУ.
Черемушкина Наталья Васильевна – кандидат медицинских наук, ассистент кафедры пропедевтики внутренних болезней и гастроэнтерологии МГМСУ. e-mail: