Введение
Рак шейки матки является самой распространенной гинекологической опухолью, сочетающейся с беременностью. Показатели заболеваемости инвазивным раком шейки матки составляют 0,1–12,0 на 10 тыс. беременностей [1–3]. Для преинвазивного рака распространенность выше и колеблется от 13 до 27 на 10 тыс. беременностей [3].
Тенденция к увеличению сочетания рака и беременности связана с отсрочкой деторождения. Так, средний возраст первых родов в цивилизованных странах, по данным Организации экономического сотрудничества и развития (OECD), в 2009 г. приблизился к 30 годам в отличие от 20–25 лет в 1970-х [4].
Кроме того, обращает на себя внимание высокая доля заболеваемости раком шейки матки среди молодых россиянок. По данным В.И. Чиссова, рак шейки матки занимает второе место в структуре заболеваемости женщин моложе 30 лет, составив 12,5 % случаев и уступив лишь гемобластозам [5].
Лечение рака во время беременности наиболее сложно, особенно в сочетании с опухолью шейки матки, поскольку пораженной оказывается непосредственно беременная матка. При выборе метода лечения важны морфологическая структура опухоли, стадия заболевания, срок беременности, а также желание пациентки сохранить или прервать беременность.
Диагностическая тактика при преинвазивном раке шейки матки
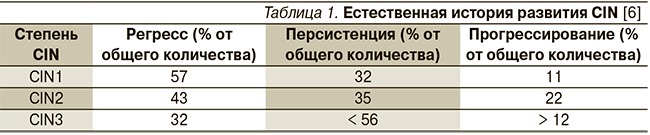
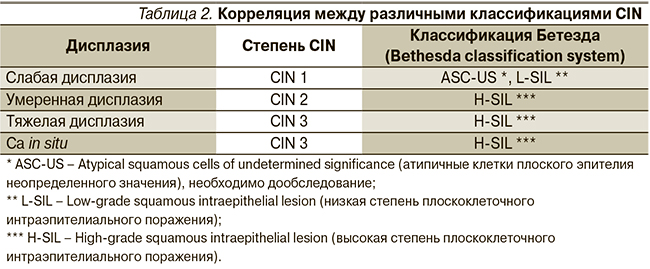
К преинвазивным формам рака шейки матки относятся дисплазии или цервикальные интраэпителиальные неоплазии 2–3-й степеней (Cervical Intraepithelial Neoplasia) – CIN. Под аббревиатурой CIN1 подразумевается легкая степень дисплазии, CIN2 – умеренная, CIN3 – тяжелая степень дисплазии и Ca in situ. Трансформация в инвазивный рак – как правило, многолетний, последовательным процесс, вероятность же обратного развития для CIN1 – 57 %, для CIN2 – 43, для CIN3 – 32 % (табл. 1) [6].
Частота встречаемости CIN во время беременности такая же, как и вне нее. В среднем у 0,5 % беременных выявляется цитологическая атипия [7]. Необходимо отметить, что при обследовании беременных увеличивается число как ложноположительных, так и ложноотрицательных цитологических результатов. Во время беременности активизируются процессы метаплазии цервикального эпителия, поэтому кольпоскопическая, цитологическая и гистологическая картины несколько меняются. С этим связана возможная гипердиагностика злокачественных процессов во время беременности. При цитологическом исследовании определяется активный цитолиз клеток с наличием массы «голых ядер».
Существует несколько классификаций дисплазий шейки матки, относительное соответствие между ними представлено в табл. 2.
Американское общество кольпоскопии и патологии шейки матки (The American Society for Colposcopy and Cervical Pathology, ASCCP) при обнаружении «атипичных клеток плоского эпителия неопределенного значения» (ASC-US) или клеток со «слабой степенью плоскоклеточных интраэпителиальных поражений» (L-SIL) во время беременности рекомендует отложить начальную кольпоскопию на период до 6 недель после родов, поскольку вероятность обнаружить CIN2–3 в этих случаях после родов составляет только 3,7 % [8, 9].
Кольпоскопически во время беременности определяются белесоватые точечные возвышения в связи с очаговой физиологической гипертрофией эпителия, обширная сеть сосудов. Во II и III триместрах наблюдаются отечные гипертрофированные сосочки слизистой цервикального канала (физиологическая эктопия призматического эпителия), при расширенной кольпоскопии определяются белые пятна метаплазированного эпителия на фоне выраженного сосудистого рисунка, из расширенных протоков функционирующих желез выделяется вязкая слизь.
При обнаружении клеток с «выраженной степенью интраэпителиальных поражений» (H-SIL) ASCCP рекомендует кольпоскопию с прицельной биопсией. В отсутствие признаков инвазии рекомендуют повторную кольпоскопию и цитологическое исследование каждые 12 недель [8, 9].
При гистологическом исследовании, как правило, наблюдаются повышенная васкуляризация, отек, лимфоцитарная инфильтрация, децидуоподобная реакция стромы. Многослойный сквамозный эпителий нередко гиперплазирован с нарушением дифференциации клеток, может наблюдаться гиперплазия и пролиферация резервных клеток.
Необходимость диагностической конизации обсуждается лишь в случаях, если подозревается инвазивный процесс, или кольпоскопия выглядит неудовлетворительной, или цитологическая картина не коррелирует с кольпоскопической. По материалам НИИ онкологии им. Н.Н. Петрова из 11 беременных, которым на ранних сроках беременности была выполнена конизация шейки матки, у одной произошел выкидыш, у второй – массивное кровотечение, потребовавшее экстренных гемостатических мероприятий. Беременность 9 больных протекала благополучно: 5 родоразрешились в срок влагалищными родами, 1 пациентке выполнено кесарево сечение в связи со слабостью родовой деятельности; остальные 4 решили прервать беременность на раннем сроке [10]. Поэтому перед решением вопроса о проведении конизации необходимо обсудить с пациенткой риски акушерских осложнений, таких как кровотечение, истмико-цервикальная недостаточность и потеря плода.
Таким образом, при обследовании беременных женщин сохраняется принцип двухэтапности диагностики ранних форм рака шейки матки. Основным методом первичного выявления преклинического рака шейки матки является цитологическое исследование (I этап). При сомнительных и позитивных цитологических данных применяется комплекс диагностических методов: кольпоскопия, повторное цитологическое исследование и прицельная биопсия Ц как во время беременности, так и после (II этап). Как исключение – при подозрении инвазивного роста опухоли при нежелании женщины прервать беременность возможно выполнение атипичной конизации (меньшего по сравнению с общепринятым объемом) или клиновидной биопсии во время беременности.
Лечебная тактика при CIN
Тактика ведения беременных с CIN в настоящее время выжидательная, поскольку риск прогрессирования в инвазивный рак за столь короткий промежуток времени крайне низкий: 0,0–0,4 % [11].
Из 12 больных, прослеженных в НИИ онкологии им. Н.Н. Петрова, лечение Са in situ которых было отложено на послеродовый период (через 2–6 месяцев), у 8 в удаленном конусе шейки матки была выявлена карцинома in situ, у остальных 4 –эндоцервикоз [2]. Следовательно, конизация шейки матки может быть выполнена через 6–8 недель после завершения беременности, а именно: после срочных влагалищных родов.
Отсутствие необходимости кесарева сечения при CIN2–3 достаточно давно продемонстрировано рядом публикаций [12–14]: регресс интраэпителиальных неоплазий зарегистрирован в 60 % случаев после влагалищных родов и только в 0–40 % – после кесарева сечения, что позволяет рекомендовать роды через естественные родовые пути при CIN2–3.
В табл. 3 представлена лечебная тактика при CIN3 во время беременности.
Несомненно, при планировании беременности женщина должна пройти всестороннее обследование, включая цитологическое исследование шейки матки на онкопатологию. В случаях выявления CIN2, 3 (умеренной и тяжелой дисплазии, Ca in situ) до планируемой беременности показана конизация шейки матки с последующим цитологическим мониторингом. В отсутствие рецидива заболевания можно рекомендовать беременность. Выполнение органосохраняющей операции позволяет практически в 100 % случаев излечить женщину от злокачественного процесса и сохранить фертильность. Однако надо помнить, что даже такого рода минимальные хирургические операции могут сопровождаться гинекологическими и акушерскими осложнениями по типу стеноза цервикального канала, истмико-цервикальной недостаточности или дискоординированной родовой деятельности. Для исключения развития различного рода осложнений после лечения предрака шейки матки оптимальным было бы вообще исключить возникновение у женщины цервикальных неоплазий шейки матки. Известно, что важную роль в развитии CIN играет персистенция вируса папилломы человека (ВПЧ). Инфицирование ВПЧ достигает высоких значений как в России, так и в европейских странах, большинство случаев инфицирования заканчивается спонтанным выздоровлением, однако при персистенции инфекции запускаются механизмы трансформации эпителия, что может приводить к негативным последствиям. По уровню агрессии ВПЧ делят на «онкогенные» и «неонкогенные» типы. К ВПЧ высокого онкогенного риска относят 16-й, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82-й типы.

На основании мировых данных о наиболее распространенных онкогенных типах ВПЧ в настоящее время разработаны и широко используются профилактические вакцины, задачей которых служит предотвращение инфицирования ВПЧ с целью снижения заболеваемости раком шейки матки.
В мире зарегистрировано две рекомбинантные вакцины: бивалентная, содержащая агенты против 16-го и 18-го типов, и квадривалентная, содержащая дополнительно 2 агента против 6-го и 11-го типов (низкого онкогенного риска). Регламентированный возраст вакцинации бивалентной вакциной с 10 до 45 лет, квадривалентной – с 9 до 26. В конечной стадии разработки (на этапе III фазы испытаний) находится 9-валентная профилактическая вакцина (против 6-й, 11, 16, 18, 31, 33, 45, 52, 58-й типов). Вакцины, зарегистрированные в Российской Федерации, представлены бивалентной (Церварикс) против 16-го и 18-го типов и квадривалентной (Гардасил) против 16-го, 18, 6 и 11-го типов) с возможностью вакцинировать от 10 до 45 лет бивалентной, от 9 до 26 – квадривалентной вакциной. Эффективность и безопасность обеих вакцин основаны на большом числе наблюдений.



