Введение
Клинические исследования патогенеза новой коронавирусной инфекции COVID-19 (CoronaVirus Disease, 2019) убедительно доказали, что ведущим звеном патогенеза этого заболевания является системная воспалительная реакция с разнообразным клиническим течением: от легкого самоограничивающегося заболевания дыхательных путей до тяжелой прогрессирующей пневмонии, полиорганной недостаточности и смерти [2]. По данным современной литературы, вирусные элементы совместно с клетками воспаления накапливаются в эндотелиальных клетках, что в конечном счете приводит к развитию эндотелиальной дисфункции (ЭД) и к периваскулярному воспалению, которое усиливает повреждение эндотелия, приводит к последующей ишемии внутренних органов с развитием полиорганной недостаточности [3]. Следовательно, развитие тяжелого эндотелиита может быть характерной чертой тяжелого течения COVID-19 [4]. В одном эксперименте было продемонстрировано, что уменьшение активности ангиотензинпревращающего фермента-2 и повышение уровня ангиотензина-П усиливает повреждение эндотелия в сосудах легких, приводя к развитию острого респираторного дистресс-синдрома, который служит основной причиной тяжелых осложнений и летальности при COVID-19 [5]. Многочисленные статьи свидетельствуют о значимости ЭД в развитии и тяжести COVID-19. Кроме того, в тех же статьях уделяется внимание клинической пользе измерения биомаркеров, отражающих наличие ЭД [6, 7]. По некоторым доступным исследованиям, у пациентов с COVID-19 наблюдалась связь между маркерами воспаления, коагуляции, ЭД и летальностью [8, 9]. Однако в настоящий момент существует небольшое количество доступных биомаркеров, измерение которых можно использовать в клинической практике для оценки ЭД. Одним из таких маркеров является адреномедуллин.
Адреномедуллин - это многофункциональный пептид, или по-другому гормокин, выделенный японскими учеными K. Kitamura et al. в 1993 г. из феохромоцитомы человека, состоящий из 52 аминокислот, принадлежащих к семейству вазоактивных пептидных гормонов, связанных с геном кальцитонина [10]. Адреномедуллин обладает сильным сосудорасширяющим действием, снижает как системное, так и периферическое сосудистое сопротивление опосредованно через усиление синтеза эндотелиальными клетками оксида азота, повышением концентрации цАМФ и кальция [11]. Кроме того, он поддерживает целостность эндотелия за счет снижения его проницаемости, а при нарушении тканевой микроциркуляции оказывает протективный эффект, препятствуя развитию тканевой гипоксии [12, 13]. Обширное повреждение эндотелия и легких, связанное с инфекцией SARS-CoV-2, вызывает нарушение в системе адреномедуллина, особенно при тяжелом течении, что приводит к повышению уровня адреномедуллина в плазме крови. Это приводит к усилению внутрисосудистой проницаемости, которая представляет собой первый этап активации каскада воспаления и свертывания крови [14]. Повышение концентрации адреномедуллина в крови свидетельствует о развитии органной недостаточности, что потенциально дает возможность использовать его в качестве раннего маркера с диагностическими и прогностическими целями при различных заболеваниях [15].
Измерить концентрацию адреномедуллина в плазме затруднительно вследствие его короткого периода полувыведения (около 22 минут), а также за счет его быстрого разложения специфическими протеазами [16]. Решить данную проблему можно путем измерения среднерегионарного фрагмента молекулы проадреномедуллина (про-АДМ). Данная молекула представляет собой более стабильное, чем адреномедуллин, соединение, имеющее более длительный период полувыведения, отщепляющееся от молекулы предшественника в концентрации 1:1 и не подвергающееся разрушению протеазами [17]. Недавнее исследование показало, что измерение уровня про-АДМ позволяет выявлять лиц с повышенным риском летального исхода и стратифицировать пациентов по группам риска и необходимости госпитализации в реанимационное отделение [18].
Беря во внимание тот факт, что эндотелиопатия играет одну из ключевых ролей в патогенезе и исходе лечения COVID-19, а адреномедуллин оказывает протективное действие на эндотелий, изучение динамики его уровня у пациентов с новой коронавирусной инфекцией представляет как научный, так и практический интерес.
Цель исследования: изучить динамику уровня про-АДМ у пациентов с инфекцией COVID-19 и определить корреляцию уровня про-АДМ с тяжестью состояния, а также с другими клинико-диагностическими показателями.
Методы
В проспективное одноцетровое исследование были последовательно включены 140 пациентов старше 18 лет, госпитализированных с диагнозом «новая коронавирусная инфекция» в ГБУЗ Москвы «Городская клиническая больница № 4» ДЗМ в период с июня по сентябрь 2021 г. Протокол исследования был одобрен локальным этическим комитетом Первого Московского государственного медицинского университет им. И.М. Сеченова Минздрава РФ (Сеченовский Университет) в 22.01.2021 и проводился в соответствии с принципами, изложенными в Хельсинкской декларации. Критериями включения в исследование стали подписанное информированное согласие, возраст от 18 лет и старше, подтвержденная методом полимеразной цепной реакции (ПЦР) коронавирусная инфекция, наличие очаговых изменений в легких по данным компьютерной томографии (КТ). Критерии невключения: возраст младше 18 лет, отсутствие подписанного информированного согласия, отрицательный результат ПЦР, наличие бактериальной инфекции, тяжелое состояние пациента на момент поступления. Основной конечной точкой исследования стала смерть пациента, включенного в исследование.
У всех пациентов новая коронавирусная инфекция была подтверждена инструментальными и клинико-диагностическими методами, включая положительный результат исследования мазков на РНК SARS-CoV-2 методом ПЦР. Лечение проводилось согласно временными методическим рекомендациям «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 11 (07.05.2021)» [19]. При госпитализации для первичной оценки тяжести состояния пациентов использовалась шкала NEWS (National Early Warning Score). [20].
Сбор данных производился из электронных медицинских карт и лабораторных информационных систем. Для пациентов, включенных в исследование, были извлечены демографические показатели, сопутствовавшие заболевания, результаты лабораторных тестов.
Образцы венозной крови для измерения про-АДМ были собраны в пробирки с ЭДТА (этилендиаминтетра-уксусная кислота) на первые и третьи сутки госпитализации. Полученные образцы центрифугировали в течение 10 минут, а затем плазму замораживали и хранили при -80°С до тестирования. Концентрацию про-АДМ в предварительно размороженных образцах плазмы измеряли методом иммуноферментного анализа, используя коммерческий набор Human MR pro-ADM (Mid-regional pro-adrenomedullin) ELISA Kit (FineTest®) чувствительностью 0,469 пмоль/мл.
Статистическая обработка результатов проводилась с использованием программы Medcalc®, версия 19.8. Для проверки гипотезы о нормальности распределения использовался критерий Колмогорова—Смирнова. При нормальном распределении результаты представлялись в виде среднего значения (М) и среднего квадратичного отклонения (о). В отсутствие нормального распределения данные представлены в виде медианы (Мо), минимального (min) и максимального (max) значений. При сравнении данных использован U-тест Манна—Уитни, Пирсона, для парных выборок — тест Уилкоксона. Распределение больных в группах оценивали по х2-критерию. Для изучения корреляции между явлениями использовался коэффициент ранговой корреляции Спирмена. Значения p<0,05 приняты статистически значимыми.
Результаты
В зависимости от исхода заболевания все больные, включенные в исследование, были разделены на две группы: выписанные с выздоровлением или улучшением (n=110) и умершие во время пребывания в стационаре (n=30). Клиническая характеристика больных представлена в табл. 1.
Группы статистически значимо не различались по полу, температуре тела, уровню сатурации, ЧСС (частота сердечных сокращений) и ЧДД (частота дыхательных движений). Умершие пациенты имели статистически значимо больший возраст, более высокую оценку по шкале NEWS, более тяжелую степень поражения легких по данным КТ, более продолжительное время госпитализации.
Таким образом, основные клинические различия в группе пауциентов с неблагоприятным течением инфекции COVID-19 были степень поражения легких по данным КТ и число баллов по шкале NEWS. Значения уровня про-АДМ, степень поражения легких по КТ-ОГК и число баллов по шкале NEWS в зависимости от исхода заболевания представлены в табл. 2.

В среднем у пациентов с неблагоприятным исходом степень поражения легких по данным КТ была выше 75%, а оценка по шкале NEWS составила 5 баллов, что было статистически значимо выше, чем у больных с благоприятным течением инфекции COVID-19. Уровень про-АДМ был значительно выше в группе пациентов с неблагоприятным исходом заболевания, он превышал значения в группе больных с благоприятным исходом в 6,85 раза.
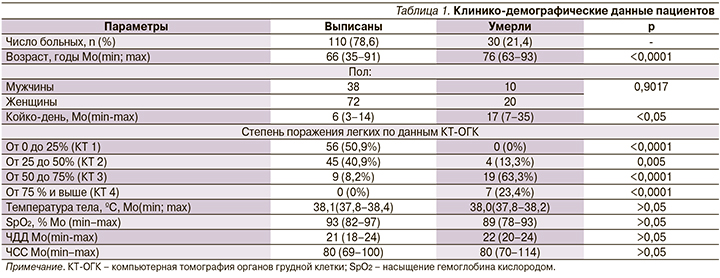
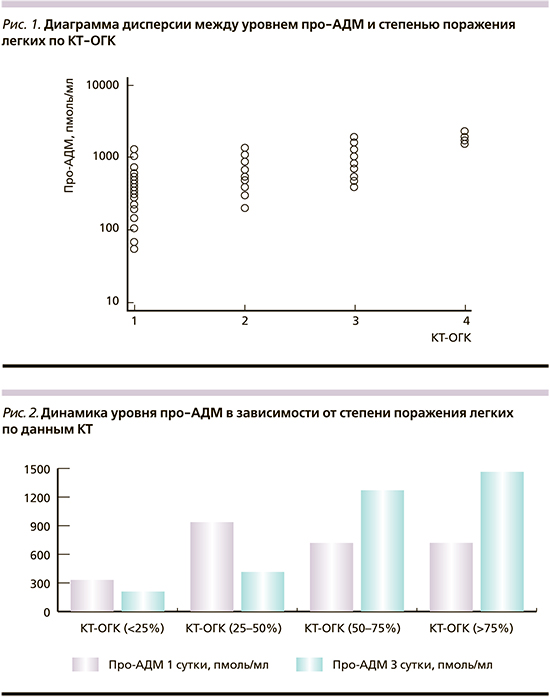
Распределение больных по уровню про-АДМ в зависимости от степени поражения легких по данным КТ-ОГК представлена на рис. 1. Отмечалась высокая степень корреляции между уровнем про-АДМ rs=0,7 (95% доверительный интервал - ДИ: 0,493-0,779; p<0,0001). У пациентов с 1-й ст. поражения легких Мо про-АДМ составила 332,2 пмоль/л против 938,7 у больных со 2-й ст. (р<0,05), у больных 3-й ст. он был статически значимо выше 1272,3 пкмоль/л (р<0,05), а при 4-й ст. он составил 1456,6 пмоль/л (р<0,05). Также при оценке изменения уровня про-АДМ на 3-й день заболевания у больных с 1-й и 2-й ст. поражения легких отмечалось статистически значимое снижение уровня про-АДМ, в то время как у больных с 3-й и 4-й ст. он статистически значимо возрастал (рис. 2).
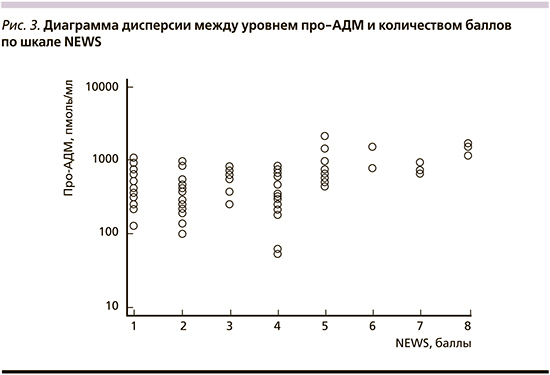
Также отмечалась связь между оценкой тяжести состояния по шкале NEWS и уровнем про-АДМ. Коэффициент корреляции составил rs=0,6 (95% ДИ: 0,229-0,626; p<0,0001), диаграмма дисперсии представлена на рис. 3. У пациентов с 1-4 числами баллов по NEWS Мо про-АДМ составила 471,5 пмоль/мл против 1043,8 у пациентов с 5-8 баллами (p<0,05).
Обсуждение
Прямое вирусное повреждение эндотелия и периваскулярное воспаление описаны как важные патогенетические механизмы изменения микроциркуляции и повреждения органов у пациентов с COVID-19. Посмертные исследования выявили наличие поврежденного эндотелия, разрушенные мембраны эндотелиальных клеток и ангиогенез у пациентов, умерших от COVID-19 [21]. Эпидемиологические исследования демонстрируют, что пациенты с COVID-19, у которых заболевание протекает в тяжелой в форме и требует госпитализации, чаще всего имеют сопутствующие заболевания, такие как артериальная гипертензия, сахарный диабет, хроническая сердечно-сосудистая недостаточность [22]. Все эти заболевания связаны с развитием хронической ЭД, которая ухудшает течение многих заболеваний, в особенности новой коронавирусной инфекции [23]. Поскольку раннее выявление факторов, ассоциированных с тяжелым течением COVID-19, может помочь грамотно и своевременно организовать надлежащую медицинскую помощь, оценка эндотелиального повреждения путем измерения эндотелиальных биомаркеров, в частности про-АДМ, может помочь улучшить стратификацию таких пациентов [24]. В некоторых исследованиях сообщалось о биохимических доказательствах ЭД у пациентов с CVOID-19, но использованные методологии являются громоздкими и неприменимыми для клинической практики в качестве быстрого лабораторного теста [25]. В этом смысле автоматическое измерение уровня про-АДМ как суррогата активности адреномедуллина, который играет одну из ключевых ролей в снижении сосудистой проницаемости и обеспечивает стабильность и целостность эндотелия, может представлять интерес для ранней диагностики ЭД у пациентов с COVID-19.
Ранее сообщалось и о прогностической ценности про-АДМ при неинфекционных заболеваниях, таких как острая легочная эмболия и инфаркт миокарда [26, 27], а также при инфекционных заболеваниях, включая внебольничную пневмонию и сепсис [28, 29]. Также прогностическая роль про-АДМ была продемонстрирована и при вирусных заболеваниях, а в недавнем консенсусном документе было предложено измерять его для определения прогноза пациентов с COVID-19 [30, 31]. Недавние обсервационные исследования потвердили, что высокие значения про-АДМ в значительной степени коррелируют с тяжестью течения заболевания, органной недостаточностью и более худшим прогнозом [32].
Цель нашего исследования состояла в том, чтобы выяснить, насколько значимо коррелирует уровень про-АДМ у пациентов с COVID-19 со степенью тяжести их состояния. Нами обнаружено, что, чем обширнее поражение легочной ткани по данным КТ, а также чем выше балл по шкале NEWS, тем выше концентрация про-АДМ в крови, что согласуется с данными, представленными ранее. Следовательно, повышенная экспрессия и активность про-АДМ отражают реакцию на повреждение и дисфункцию эндотелия, а вместе с ним и развитие органной недостаточности.
Заключение
Системное воспаление при инфекции COVID-19 приводит к повышенной экспрессии про-АДМ. Повышение уровня про-АДМ находится в прямой зависимости от тяжести течения, напрямую зависит от клинических проявлений инфекции COVID-19, таких как степень поражения легких и тяжести состояния больного по шкале NEWS.
Уровень про-АДМ отражает степень выраженности ЭД у пациентов с COVID-19, что дает возможность стратифицировать таких пациентов по группам риска и оценивать тяжесть течения болезни.
Вклад авторов. А.А. Астаповский, В.Н. Дроздов — концепция и дизайн исследования. А.А. Астаповский, А.А. Мещеряков, Е.В. Цепкова - сбор и обработка материала. В.Н. Дроздов - статистическая обработка данных. А.А. Астаповский - написание текста. Е.В. Ших, Г.Г. Мелконян, Н.Б. Лазарева - редактирование.
Финансирование. Авторы заявляют о финансировании проведенного исследования из собственных средств.



