Остеопороз относится к заболеваниям, разрушающим костную ткань и ведущим к значительному снижению качества жизни, инвалидности и смертности от его последствий –низкотравматических переломов костей [1]. Наиболее часто переломы, связанные с хрупкостью костной ткани, происходят в позвоночнике, проксимальном отделе бедра и в предплечье. У женщин в постменопаузе вероятность в течение последующей жизни получить перелом в одном из этих участков скелета превышает риск развития рака молочной железы (приблизительно 12%) и составляет 40% и более в странах Западной Европы, что сопоставимо с риском коронарной болезни сердца [2]. Переломы наносят значительный ущерб как самому пациенту, так и общественному здравоохранению, и затраты на их лечение постоянно растут как в малоразвитых, так и в развитых странах. Основными причинами увеличения бремени переломов является рост доли пожилых людей в обществе и тот факт, что большинство пациентов с остеопорозом остаются нелеченными. В исследованиях было показано, что менее 20% пациентов с уже имеющимися низкотравматическими переломами в анамнезе получали терапию для предотвращения дальнейших переломов [3, 4]. Одним из способов снижения риска переломов является терапия эффективными антиостеопоротическими препаратами, количество которых постепенно увеличивается. Известные в настоящее время препараты для лечения остеопороза способны снижать риск переломов позвонков на 40–79%, периферических переломов – на 20% и риск переломов бедра – до 40% [5]. Однако любая терапевтическая схема лечения остеопороза включает препараты кальция и витамина D для восполнения недостающих организму микронутриентов, для потенцирования антирезорбтивного эффекта препаратов и для уменьшения побочных эффектов от основной терапии.
Комбинации витамина D с кальцием доказали свою эффективность при целевом использовании для предупреждения переломов у пациентов из группы риска по недостаточности кальция и/или витамина D. К ним относятся пожилые люди, в т.ч. проживающие в домах престарелых, пациенты с остеопорозом, принимающие антирезорбтивные или анаболические препараты, пациенты, получающие терапию глюкокортикоидами [6–10]. Положительный эффект наиболее заметен при ежедневном приеме 800 МЕ витамина D в сочетании с 1000–1200 мг кальция [8, 11].
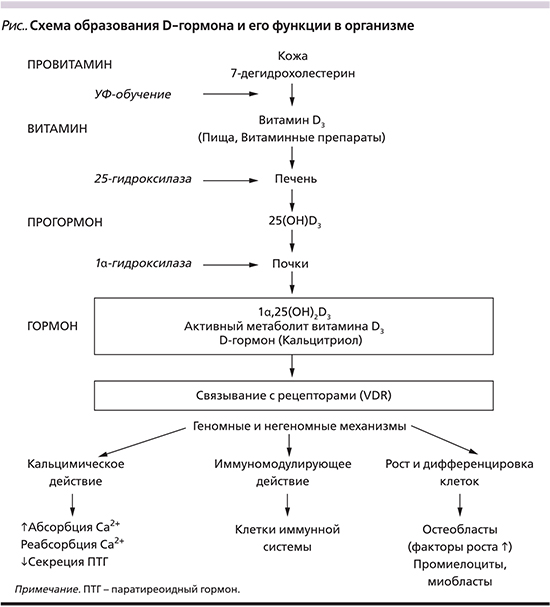
Витамин D используется в разных формах для профилактики и лечения остеопороза. Неактивный или нативный витамин D (холекальциферол или эргокальциферол) применяется с профилактической целью, а активные метаболиты витамина D (кальцитриол и альфакальцидол) – для лечения остеопороза, особенно вызванного другими заболеваниями или приемом лекарственных препаратов, влияющих на костную массу. Для того чтобы оценить точки приложения разных форм витамина D, необходимо понимать механизмы образования активных метаболитов и D-гормона из нативной формы витамина D. Упрощенная схема дана на рисунке.
Витамин D3 (холекальциферол) образуется в коже путем фотохимического синтеза при воздействии инсоляции. Другим источником витамина D является эргокальциферол или витамин D2, который поступает с пищей. Нативный витамин D биологически не активен и для того, чтобы взаимодействовать с рецепторами к витамину D в органах и тканях и осуществлять разные функции в организме, он должен превратиться в активную форму. Биотрансформация витамина D происходит сначала в печени, затем в почках. Первое гидроксилирование происходит в печени под действием 25-гидроксилазы, а второе – в почках при участии 1α-гидроксилазы. В результате этих процессов, происходящих под строгим физиологическим контролем, в частности паратиреоидным гормоном (ПТГ), образуется активная форма D-гормон или кальцитриол (1,25(ОН)2D3). D-гормон циркулирует в крови и связывается с рецепторами к витамину D, которые представлены более чем в 30 различных органах и тканях. Это обусловливает множественные плейотропные эффекты D-гормона – на костную ткань, нервно-мышечную проводимость, иммунную систему, рост и дифференцировку клеток, активность кишечника и функцию паращитовидных желез.
Альфакальцидол – это синтетический аналог кальцитриола и отличается от него лишь отсутствием в структуре гидроксильной группы в положении 25. Сам по себе альфакальцидол имеет небольшую биологическую активность и приобретает ее только после превращения в кальцитриол, проходя при этом только одно гидроксилирование в печени. Хотя и альфакальцидол, и кальцитриол дозозависимо снижают скорость потери костной массы, использование последнего связано с потенциальным риском развития гиперкальциемии, что при приеме альфакальцидола бывает очень редко. Этот феномен объясняется тем, что кальцитриол связывается с рецепторами к 1,25(ОН)2D3 в кишечнике сразу после приема с последующей индукцией абсорбции кальция и быстрым увеличением концентрации электролита в крови. Напротив, альфакальцидол, являясь пролекарством, попадает в кишечник в неактивной форме, поэтому, всасываясь в кровь, не вызывает резкого повышения пиковой концентрации кальция в крови.
В ряде клинических исследований были показаны преимущества активных метаболитов витамина D по сравнению с нативным витамином D в повышении минеральной плотности кости (МПК) и предотвращении переломов как в виде монотерапии, так и в комбинации с заместительной гормональной терапией и бисфосфонатами [12–14]. Активные метаболиты витамина D – единственный класс антиостеопоротических препаратов, которые хорошо комбинируются с любыми другими антирезорбтивными и анаболическими средствами. Что касается сравнения влияния активных метаболитов витамина D с препаратами нативного витамина D в предупреждении переломов, то проведенный в 2005 г. мета-анализ, включивший 14 исследований по нативному витамину D, 9 – по альфакальцидолу и 10 – по кальцитриолу, показал большую эффективность аналогов D-гормона в отношении снижения риска переломов позвонков и периферических костей при первичном остеопорозе (отношение шансов (ОШ)=13,4%, 95% доверительный интервал (ДИ) 7,7–19,8 против ОШ=6%, 95%ДИ 1–12, при сравнении между классами препаратов, р<0,05). При оценке влияния на МПК в позвоночнике также были получены достоверные преимущества применения группы активных метаболитов (effect-size (ES)=0,43 на фоне использования активных метаболитов против ES=0,21 у нативного витамина D, р<0,05) [15]. В другом исследовании сравнение эффективности активных метаболитов витамина D и нативного витамина D продемонстрировало бoльшую эффективность первых в отношении переломов позвонков (ОШ=15, 95% ДИ – 6,5–25) [16].
Изучалась эффективность альфакальцидола и при стероидном остеопорозе. По данным мета-анализа, объединившего 54 клинических исследования, была показана большая эффективность активных метаболитов витамина D по сравнению с нативным витамином и/или кальцием в отношении риска переломов позвонков (относительный риск (ОР)=0,56; 95% ДИ – 0,34–0,92) [17]. Активные метаболиты витамина D в качестве средства монотерапии включены в европейские клинические рекомендации по ведению больных с глюкокортикоидным остеопорозом [18].
Среди факторов риска периферических переломов падения играют не меньшую роль, чем МПК [19, 20]. В крупномасштабном наблюдательном исследовании, включившем 66134 женщины в постменопаузе, была показана высокая частота падений: 38,2% женщин падали хотя бы 1 раз в год [21]. Самым существенным фактором риска было отмечено уже имеющееся падение в анамнезе (ОШ – 2,7). Кроме того, было выявлено 17 других независимых факторов риска: возраст старше 70 лет, наличие переломов в анамнезе, наличие таких сопутствующих заболеваний, как депрессия, последствия острой недостаточности мозгового кровообращения, артрит, заболевания почек, снижение слуха, сахарный диабет и прочие. Таким образом, для снижения риска переломов, особенно проксимального отдела бедренной кости, первоочередное значение приобретает не только увеличение минеральной плотности и качества костной ткани, т.е. лечение остеопороза, но и принятие мер по снижению риска падений.
Использование препаратов витамина D оказалось наиболее эффективным среди всех попыток воздействовать на риск падений с помощью медикаментозных вмешательств. Поскольку одной из основных причин падений является ограничение функциональных возможностей в процессе старения, развития саркопении, ухудшения нервно-мышечной проводимости и когнитивных функций, контроль и коррекция этих нарушений играют важную роль в профилактике падений [22]. Активные метаболиты витамины D за счет плейотропных эффектов оказывают разностороннее воздействие на скелетно-мышечную систему, нервно-мышечную проводимость и регуляторные механизмы костного и кальциевого обмена, обеспечивая комплексную профилактику падений.
Целый ряд исследований был проведен за последние годы по оценке влияния активных метаболитов витамина D на снижение риска падений. Mета-анализ 2008 г. показал достоверное преимущество активных метаболитов (альфакальцидола и кальцитриола) в снижении риска падений: ОР=0,79, 95% ДИ – 0,64–0,96 против ОР=0,94, 95% ДИ – 0,87–1,01 [16]. Исследование по использованию альфакальцидола в дозе 1 мкг/день в течение 3 лет показало, что прием препарата в целом не снижал риска падений (OР=0,69, 95% ДИ – 0,41; 1,16), однако среди лиц, потребляющих более 512 мг/сут кальция, снижение риска падений было достоверным (OР=0,45, 95% ДИ – 0,21; 0,97) [23].
Объяснением преимущественного влияния активных метаболитов витамина D на костно-мышечную систему по сравнению с нативным витамином служит тот факт, что нативный витамин D является не лекарственным препаратом, а пищевой добавкой (микронутриентом) и эффективен только в условиях первичного дефицита витамина D (при 25(ОН)D3 < 30 нмоль/л). Следовательно, при нормальном уровне витамина D в крови более заметное терапевтическое воздействие на кости, мышцы и другие органы-мишени оказывают аналоги D-гормона. Причинами недостаточности или дефицита нативного витамина D считают редкое пребывание на солнце, использование солнцезащитных кремов, нарушение синтеза витамина D в коже, использование гиполипидемической диеты, нарушение всасывания в желудочно-кишечном тракте, в то время как недостаточность D гормона связана с пожилым возрастом пациентов, уменьшением количества рецепторов к витамину D и их чувствительности, а также нарушением функции почек.
Поскольку завершающие стадии его метаболизма в почках регулируются по механизму обратной связи, витамин D в виде пищевой добавки существенно не влияет на уровень образования D-гормона. Кроме того, у лиц пожилого возраста, пациентов с нарушением функций почек, хроническими воспалительными заболеваниями (ревматоидный артрит, болезнь Крона, хронические обструктивные болезни легких), сахарным диабетом 1 типа, атеросклерозом, артериальной гипертонией и сердечной недостаточностью формируется недостаточность D-гормона (вследствие подавления 1α-гидроксилазы в почках), что сопровождается развитием толерантности к нативному витамину D. В этих случаях, а также у лиц, принимающих глюкокортикоиды, может снижаться количество рецепторов к витамину D или уменьшаться их восприимчивость к D-гормону в органах-мишенях [24]. Вместе с тем активные метаболиты витамина D не могут использоваться для лечения недостаточности/дефицита витамина D, потому что их метаболизм идет в обход 25(ОН)D и не способствует повышению его концентрации.
Наряду со многими факторами риска падений важное значение имеет снижение клиренса креатинина менее 65 мл/мин, при котором установлена четкая связь с увеличением склонности к падениям и доказан независимый характер этой связи. Примечательно, что в рандомизированном контролируемом исследовании, имеющем наибольшую доказательную силу, было показано достоверное снижение числа пациентов, подверженных падениям, с клиренсом креатинина ниже 65 мл/мин (OР=0,26, 95% ДИ – 0,08–0,80, р=0,019) и снижение числа падений (OР=0,29, 95% ДИ – 0,09–0,88, р=0,028) [25].
Среди клинических эффектов альфакальцидола, применяемого в дозе 1 мкг ежедневно в течение 3–6 месяцев, отмечено улучшение функции произвольных мышц за счет относительного прироста быстрых мышечных волокон типа IIA с уменьшением количества быстрых волокон типа IIB, а в последних также увеличивалось число связей между актином и миозином [26].
После 6 месяцев терапии в группе пожилых женщин с недостаточностью D-гормона отмечено повышение мышечной силы и улучшение функциональных показателей (ходьба в течение 2 минут, быстрота одевания) [27].
Наибольший опыт применения активных метаболитов витамина D в России имеет препарат Альфа Д3-Тева®, поскольку он был первым зарегистрирован для лечения постменопаузального и сенильного остеопороза и применяется у людей в возрасте старше 45 лет. Например, препарат Альфа Д3-Тева® может быть использован в дозе 0,5 мкг у людей 45–60 лет и 1 мкг у людей старше 60 лет. Вместе с тем в одном из исследований было продемонстрировано, что лечение в дозе 1 мкг способствовало наибольшей прибавке МПК и улучшению качественных характеристик кости, что сопровождалось значимым снижением риска позвоночных (ОР=0,53, 95% ДИ – 0,47–0,60) и периферических переломов (ОР=0,34 95% ДИ – 0,16–0,71). Наибольший эффект от лечения Альфа Д3-Тева® в дозе 1 мкг/сут был показан у пожилых людей с возрастным снижением скорости клубочковой фильтрации <65 мл/мин: у них также отмечено снижение риска падений на 71%. Достоверной разницы в частоте побочных эффектов (включая гиперкальциемию, кожную сыпь и зуд) у пациентов с клиренсом креатинина <65 мл/мин и >65 мл/мин как в группе лечения альфакальцидолом, так и в группе плацебо отмечено не было [25].
Адекватный профиль безопасности способствует широкому использованию препарата. В Японии среди 13 550 амбулаторных пациентов серьезные нежелательные явления не встречались, а минимальные побочные эффекты, включая гиперкальциемию, выявлены в 1,1% случаев. Повышения частоты нефролитиаза отмечено не было [28].
В заключение можно сказать, что активные метаболиты витамина D обладают многоплановым действием на разные органы и ткани, имея оптимальный профиль безопасности, в связи с этим области применения и возрастной диапазон пациентов, которым можно назначать эти препараты, достаточно широки. Поскольку наиболее убедительные результаты были показаны в отношении увеличения МПК в 2–5 раз, снижения риска переломов в 2 раза и уменьшения риска падений в 3,5 раза, аналоги D-гормона могут активно использоваться в управлении риском переломов, связанных с первичным и вторичным остеопорозом.



