Аутоиммунный гепатит (АИГ) относится к относительно редким заболеваниям печени, поражающим преимущественно женщин любого возраста, на его долю приходится 10–20 % всего спектра хронического гепатита. Представлена современная балльная система признаков для выявления АИГ, рассматривается клиническая картина АИГ. Другими аутоиммунными вариантами поражения печени являются первичный билиарный цирроз печени (ПБЦП) и первичный склерозирующий холангит (ПСХ). Обсуждаются перекрестные синдромы между различными аутоиммунными заболеваниями печени АИГ-ПБЦП и АИГ-ПСХ. Рассматриваются современные подходы к лечению АИГ и перекрестных синдромов с использованием глюкокортикоидов, азатиоприна и урсодеоксихолевой кислоты.
Аутоиммунитет и аутоиммунные заболевания человека относятся к наиболее интригующим разделам медицины с множеством неразрешенных проблем. С 1994 г. аутоиммунные поражения печени включают аутоиммунный гепатит (АИГ), первичный билиарный цирроз печени (ПБЦП), первичный склерозирующий холангит (ПСХ). АИГ представляет один из многочисленных вариантов аутоиммунных заболеваний, при котором потеря толерантности к собственным тканям является главным патогенетическим механизмом развития повреждения печени и отражает сложное взаимоотношение между запускающими аутоиммунный процесс факторами, аутоантигенами, генетической предрасположенностью и иммунорегуляторными процессами.
Определение и классификация АИГ
АИГ впервые описан Waldenstrоmв 1951 г. у молодых женщин с аменореей, высокими показателямиγ-глобулинов сыворотки и активностью гепатита. Быстрое прогрессирование в цирроз печени и высокая смертность – 80 % больных погибали в течение 5 лет после установления диагноза, обеспечили появление терминов “хронический активный гепатит” (ХАГ), “хронический агрессивный гепатит”, “люпоидный гепатит”. Позже, в конце 1960-х и начале 1970-х гг., АИГ стал первым заболеванием печени, при котором показано достоверное увеличение выживаемости большинства больных под влиянием иммуносупрессивной терапии преднизолоном или комбинацией преднизолона и азатиоприна. АИГ стали определять как “персистирующее (неразрешившееся) воспаление печени неизвестной этиологии, характеризующееся преимущественно перипортальным гепатитом или более обширным воспалительным процессом, сопровождающееся гипергаммаглобулинемией, присутствием тканевых аутоантител в сыворотке и в большинстве случаев отвечающее на иммуносупрессивную терапию”. При морфологическом исследовании в ткани печени выявляется ХАГ с портальной и перипортальной лимфоплазмоцитарной инфильтрацией, разрушающей пограничную пластинку, – т. н. ступенчатые некрозы, являющиеся основным признаком АИГ. Действительно, этот признак присутствовал обязательно при всех последующих классификациях АИГ:HBsAg-негативный, идиопатический, криптогенный, ни А ни В, стероидозависимый ХАГ. Два других диагностических признака ХАГ – значительное повышение уровня аминотрансфераз сыворотки в течение свыше 6 месяцев наблюдения за больными уточняли картину АИГ. В последующем показано, что уровни АСТ и АЛТ сыворотки плохо коррелировали с активностью ХАГ и ряд больных с высокой морфологической активностью заболевания имели очень умеренное повышение аминотрансфераз, в связи с чем обязательным в диагностике АИГ является изучение биопсии печени.
АИГ относится к относительноредким заболеваниям печени, поражающим преимущественно женщинлюбого возраста, составляет 10–20 % всего спектра хронического гепатита и представляет неоднородную группу заболеваний печени, поэтому предпринимаются попытки по разработке классификации, основанной либо на серологических, либо на генетических маркерах заболевания. Как правило, диагноз АИГ основывается на балльной системе оценки ряда клинических и лабораторных параметров. Среди диагностических признаков учитываются аутоантитела, которые гетерогенны и используются не только как диагностические маркеры АИГ, но и как основа для изучения этиологии, патогенеза и молекулярной основы повреждения. Международной группой по изучению АИГ сформулированы признаки, которые делают его диагноз определенным или вероятным. В пользу АИГ свидетельствуют женский пол, повышенный уровень сывороточных аминотрансфераз, низкий уровень щелочной фосфатазы (ЩФ), гипергаммаглобулинемия с повышением уровня IgG в сыворотке, положительные антинуклеарные
антитела (АНА), антитела к гладкой мускулатуре (АГМ), печеночно-почечные микросомальные антитела 1-го типа (LKM-1), периферические антинейтрофильные ядерные антитела или антитела к растворимому печеночному/печеночно-панкреатическому антигену (анти-SLA/LP), отсутствие антимитохондриальных антител (АМА), отсутствие гепатотропной вирусной инфекции, лекарственного или алкогольного повреждения печени, наличие перипортального гепатита при биопсии [1–3]. Диагноз АИГ становится более определенным, если у больного или в его семье имеются конкурентные иммунологические заболевания, известные HLA-маркеры и ответ на кортикостероидную терапию. Против диагноза АИГ свидетельствуют высокий уровень ЩФ, положительные АМА в сыворотке, наличие маркеров вирусов гепатита в сыворотке, факты употребления лекарств или злоупотребления алкоголем, морфологические изменения в печени, предполагающие другую этиологию (табл. 1).
Таблица 1.
Балльная система признаков для выявления АИГ.
Диагноз АИГ основывается на наличии характерных клинических, лабораторных, серологических и генетических признаков и исключении заболеваний, сходных с АИГ, а также нанаступлении ремиссии при лечениииммунодепрессантами и развитии обострения заболевания после отменыиммуносупрессии. Показано, что прогностическими факторами диагнозаАИГ являются его морфологическиепризнаки, титры аутоантител, уровеньгамма-глобулинов или IgG и отсутствие вирусного гепатита. С учетом сложностей работы с балльной системной оценкой признаков АИГ в 2008 г. предложена упрощенная система диагностических признаков, позволяющих выявлять определенный или вероятный АИГ [4, 5].
В соответствии с профилем выявляемых аутоантител выделяют два типаАИГ [1, 3, 6, 7]. АИГ 1-го типа характеризуется наличием АНА и/или АГМ,на его долю приходится 85 % всехслучаев АИГ. Данный вариант АИГнаблюдается преимущественно у женщин (8 : 1), поражает лиц старшего возраста, характеризуется менее частымразвитием внепеченочных проявлений и хорошим прогнозом.
АИГ 2-го типа отличается наличием анти-LKM-1. На долю АИГ 2-го типа приходится до 15 % случаев АИГ. Чаще заболевание встречается у молодых женщин, 50–75 % больных – дети от 2 до 15 лет с высокой активностью заболевания, яркими внепеченочными проявлениями и серьезным прогнозом. Около 10–20 % больных аутоиммунным гепатитом серонегативны на АНА, АГМ и анти-LKM-1, хотя позже в течение заболевания эти антитела могут появляться. Данный феномен затрудняет выявление АИГ и относит этих больных к криптогенному хроническому гепатиту. Приблизительно 60–90 % больных имеют циркулирующие антинейтрофильные цитоплазматические аутоантитела с перинуклеарным окрашиванием, т. к. мишенью является антиген на периферии ядра, а не в цитоплазме. Рекомендовано проводить обследование данной группы больных на более редкие антитела: анти-SLA/LP, азиалогликопротеиновые рецепторы, антитела к эндомизию, хроматину, лактоферрину, Saccharomyces cerevisiae.
Клиническая характеристика АИГ
Клинический спектр АИГ варьируется от тяжелого острого гепатита(иногда фульминантного течения),хронического гепатита различной степени тяжести и выраженности воспалительной активности в печени доатипично протекающих состояний безсвойственных данной форме гепатитааутоантител в сыворотке крови с морфологической картиной центролобулярных некрозов в 3-й зоне гепатоцитов, признаками поражения желчных протоков и клиническими проявлениями других аутоиммунных поражений печени (ПБЦП или ПСХ), получивших название перекрестных синдромов иливариантных форм АИГ. У 50 % больных АИГ проявляется лабораторными признаками хронического гепатита. аиболее часто отмечаются слабость, повышенная утомляемость, сонливость, снижение массы тела, нередко – лихорадка или субфебрилитет, сыпь на теле, артралгии, миалгии, олиго- или дисменорея. При обследовании выявляют гепато-, спленомегалию, асцит, энцефалопатию. У половины пациентов желтуха или указание в анамнезе на эпизод желтухи. У 30 % больных при первом обследовании выявляют сформировавшийся цирроз печени, а 40 % обнаруживают иммунные нарушения, чаще – поражение щитовидной железы или суставов, что увеличивает подозрение на АИГ. Приблизительно 30–40 % больных демонстрируют острое начало заболевания с выраженной желтухой, и при несвоевременном выявлении АИГ заболевание может прогрессировать в подострую печеночную недостаточность с необходимостью неотложной трансплантации печени. Наконец, у 10–20 % больных отмечается бессимптомное течение АИГ, единственным маркером которого может быть случайно выявленное повышение трансаминаз сыворотки. Нередко признаки поражения печени обнаруживают при обследовании по другому поводу – рецидивирующая кожная сыпь, артралгии. Эти больные имеют умеренную активность воспалительного процесса в печени, хорошо отвечают наиммуносупрессивную терапию [1–3, 6]. У части женщин АИГ развивается в период беременности или сразу после родов, до этого протекая бессимптомно. По демографическим показателям, частоте развития цирроза печени эти больные не отличаются от пациентов с острым началом заболевания, высокой активностью гепатита и желтухой. В связи с тем что АИГ может протекать бессимптомно, у части больных возникают определенные трудности дифференциального диагноза с другими заболеваниями. Отсутствие патогномоничных АИГ признаков делает его диагнозом исключения и требует обследования на маркеры вирусов гепатита, наличие ПБЦП или ПСХ, болезни Вильсона–оновалова и дефицита α1-антитрипсина, так же как уточнения других этиологических факторов – алкоголя, лекарств. В последние годы показано, что, несмотря на преимущественное поражение женщин, АИГ стал чаще диагностироваться у мужчин, встречаясь в любом возрасте, все чаще выявляется у 40-летних больных. Заболевание характеризуется разнообразными вариантами течения – от высокой степени активности до спонтанного улучшения и даже ремиссии болезни, несмотря на гистологические признаки сохраняющейся активности процесса в печени, нередко с периодами резкого обострения через непродолжительный период. Типичными для аутоиммунного гепатита являются 5–10-кратное повышение уровня трансаминаз сыворотки, признаки нарушения обмена билирубина и гиперпротеинемия за счет гипергаммаглобулинемии, обусловленной повышением IgG-сыворотки. Уровень ЩФ нормальный или слегка повышен; может быть повышена активность γ-глютамилтранспептидазы (ГГТП). Почти все больные АИГ демонстрируют различный спектр аутоантител в сыворотке крови, как правило не отражающих тяжесть заболевания. До 70–80 % больных серопозитивны по АНА или АГМ или обоим аутоантителам. Очень небольшой процент больных имеют анти-LKM-1, реагирующие с изоэнзимом цитохрома Р450 2D6. Как правило, данные пациенты серонегативны по АНА и АГМ, поэтому все больные с подозрением на аутоиммунный гепатит проходят тестирование на АНА, АГМ и анти-LKM-1 [7].
Диагноз АИГ основывается наисключении других заболеваний печени, выявлении гиперферментемии,повышении IgG, гистологических изменениях, выявлении периферических антинейтрофильных ядерных антител или антитиреоидных аутоантител, в т. ч. при нормальной функции щитовидной железы, и специальном обследовании на другие, более редкие антитела, имеющие потенциальное
значение для диагноза аутоиммунный гепатит: антитела к азиалогликопротеиновым рецепторам, растворимомупеченочному антигену (анти- SLA), к антигену печень–поджелудочная железа (анти-LP), который оказался идентичным анти-SLA и обозначается как анти-SLA/LP. Еще один показатель, используемый в диагностике АИГ, – низкий уровень С4 компонента комплемента. Хотя данный признак не является специфичным, он может свидетельствовать в пользу аутоиммунного гепатита у больных без соответствующихаутоантител.
Среди морфологических признаков наряду с характерным для АИГ перипортальным гепатитом (описываемым как ХАГ) с плотной, преимущественно лимфоплазмоцитарной инфильтрацией портальных трактов, перипортальной и перисептальной областями с наличием ступенчатых некрозов гепатоцитов, а в ряде случаев – более тяжелыми порто-портальными или порто-септальными мостовидными некрозами выявляют формирование лимфоцитарных розеток, очаговую регенерацию клеток и пролиферацию желчных протоков даже в отсутствие цирроза печени. Ни один из этих признаков не является патогномоничным аутоиммунному гепатиту, т. к. встречается при других заболеваниях печени. При выявлении гранулем или типичных для ПБЦП или ПСХ изменений желчных протоков в виде хронического негнойного деструктивного холангита, выраженного концентрического перидуктального фиброза диагностируется вариантная форма АИГ. В сомнительных случаях, особенно при наличии стеатоза печени, скопления очагов лимфоидных клеток в печени, сидероза, необходимо проводить холангиографию для исключения ПСХ в связи с наличием особой формы заболевания у детей, называемой аутоиммунным склерозирующим холангитом без АМА.
Генетические факторы при АИГ
Как и при большинстве других аутоиммунных заболеваний, интенсивноизучается генетическая основа АИГ.В Европе АИГ ассоциирован сA1-B8-DR3 гаплотипом и особенно с DR3 и DR4 аллотипами, которые являются независимыми факторами риска его развития. В Японии сильная ассоциацияотмечена с DR4. HLA-антигены DR3 и DR4 характеризуют различные уровни прогрессирования АИГ. Известно, что больные с DR3-аллотипом любого возраста чаще имеют высокую активность заболевания, реже формируют ремиссию при иммуносупрессивной терапии, чаще дают обострения иимеют более неблагоприятный прогноз болезни. Наоборот, больные с DR4-аллотипом, часто пожилого возраста с низкой и умеренной степенью активности, быстрее достигают ответа на иммуносупрессивную терапию. Низкая концентрация С4 компонента комплемента также имеет определенное прогностическое значение – у больных отмечается высокая частота рецидивов АИГ и высокая смертность. Набор генетических маркеров весьма сложен и каждый год увеличивается на несколько новых генетических признаков. Спектр полиморфизма генов, ассоциированных с АИГ, включает цитокины, например фактор некроза опухоли-α, молекулы адгезии, например CTLA4. Однако изучение генетической основы АИГ в настоящее время сравнивают с “поиском иголки в стоге сена”. До сих пор мало известно о запускающих (“триггерных”) факторах, особенно о роли Т-клеточного иммунитета.
Другие аутоиммунные варианты поражения печени – ПБЦП и ПСХ
Первичные аутоиммунные холестатические варианты пораженияпечени – ПБЦП и ПСХ – относятся к медленнопрогрессирующим заболеваниям, характеризующимсяобязательным поражением желчныхпротоков с развитием хроническогонегнойного деструктивного холангита. Для ПБЦП типичен гранулематозный негнойный деструктивныйхолангит с поражением междольковых и септальных желчных протоков,а для ПСХ – фиброзный облитерирующий негнойный деструктивныйхолангит, поражающий как внутри-, так и внепеченочные желчные протоки. При ПБЦП наряду с синдромом холестаза выявляются АМА, наиболее специфичны – М2-АМА, направленные против Е2-субъединицы пируватдегидрогеназы, повышение IgM сыворотки и иммуноопосредованные внепеченочные синдромы – тиреоидит Хашимото, синдром Шегрена,фиброзирующий альвеолит, тубулоинтерстициальный нефрит, целиакия, а также сочетание с заболеваниями ревматического круга – системной склеродермией, ревматоидным артритом, системной красной волчанкой. АНА выявляют у 52 % больных ПБЦП с отражением универсального характера этих антител при различных иммуноопосредованных заболеваниях. ПБЦП встречается преимущественно у женщин среднего и пожилого возраста. Выделяют вариант ПБЦП без АМА – аутоиммунный холангит без АМА. ПСХ чаще развивается у мужчин (2 : 1), нередко (в 70–90 % случаев) сочетается с воспалительными заболеваниями кишечника – язвенным колитом или болезнью Крона. Наряду с синдромом холестаза типичным для ПСХ является изменение желчного дерева при эндоскопической ретро́градной панкреатохолангиографи́и (ЭРПХГ) или магнитно-резонансной томографической (МРТ) холангиографии по типу “четок” или “бус”, у 70 % больных в сыворотке крови выявляются перинуклеарные антинейтрофильные цитоплазматические антитела.
Вариантные (атипичные) формы АИГ
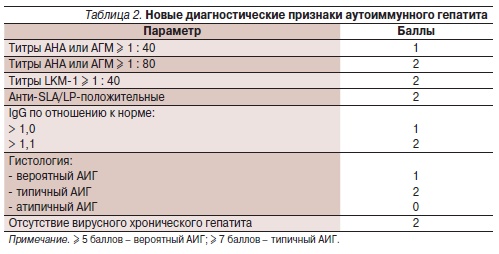
Перекрестные синдромы между различными аутоиммунными заболеваниями печени (АИГ, ПБЦП, ПСХ) содновременным выявлением клинических, биохимических, серологических и гистологических признаков, свойственных этим заболеваниям, встречаются часто (в 18 %), трудны для диагностики в связи с отсутствием четких разграничений и нуждаются в изменении стратегии лечения. Известно,что у 5–8 % больных с диагнозом АИГ имеются признаки ПБЦП – повышение уровня билирубина и ЩФ, гистологические изменения в ткани печени. В то же время у 9–19 % больных ПБЦП имеются признаки АИГ. Диагноз АИГ, как уже говорилось, базируется на выявлении вероятного или типичного заболевания согласно балльной системе оценки признаков, претерпевшей за последние 2 десятилетия ряд изменений и включившей критерии, исключающие другие заболевания печени (табл. 1 и 2). Для диагностики вариантных форм аутоиммунного гепатита предложены определенные диагностические признаки, чувствительность и специфичность которых пока не оценены [8–11]. О синдроме перекреста АИГ–ПБЦП свидетельствуют два из трех признаков АИГ и два из трех признаков ПБЦП.
Диагноз АИГ основывается на следующих признаках:
• повышение АЛТ ≥ 5-кратного уровня верхней границы нормы;
• повышение IgG ≥ 2-кратного уровняверхней границы нормы или выявление АГМ;
• умеренная или высокая степень перипортальных или перисептальных лимфогистиоцитарных ступенчатых некрозов.
Для диагноза ПБЦП необходимыдва из трех признаков:
• повышение содержания ЩФ ≥2-кратного уровня верхней границынормы или повышение активностиГГТП ≥ 5-кратного значения верхней границы нормы;
• выявление АМА;
• морфологические признаки поражения желчных протоков в виде хронического деструктивного негнойногохолангита.
Перекрестный синдром АИГ–ПБЦП может наблюдаться в двух вариантах. Первый вариант характеризуется преобладанием гистологических признаков АИГ и биохимических, а также
серологических показателей, свойственных ПБЦП: обнаружение М2АМА, холестаза; повышение IgM приочень умеренном увеличении уровняγ-глобулинов и IgG; низкий титр АНАи/или АГМ у 31 и 9 % больных соответственно; наличие ассоциации с HLA –B8, DR3 или DR4. Второй вариант перекрестного синдрома АИГ–ПБЦПимеет гистологические признаки,типичные для ПБЦП: инфильтрациюпортальных полей, деструкцию и пролиферацию желчных протоков с уменьшением их числа и появлением гранулем в ткани печени, тесно связанных с желчными протоками. В то же времяпри морфологическом исследованииможно выявить и признаки АИГ –ступенчатые и мостовидные некрозы. АМА не выявляются, в сывороткекрови обнаруживают АНА и АГМ в 71и 37 % случаев соответственно.
Вариантная форма АИГ–ПСХ частовстречается у детей, подростков и лицмолодого возраста. У 6 % больных АИГвыявляют признаки ПСХ, а у 2–8 %больных ПСХ имеются признаки АИГ.Как правило, в этой группе больныхвстречаются воспалительные заболевания кишечника: язвенный колит у 35–60 % больных и крайне редко –болезнь Крона; нередко эту группу отличают нормальные показатели
ЩФ. Внепеченочные аутоиммунныепроявления обнаруживают при вариантной форме АИГ–ПСХ с такой жечастотой, что и при ПСХ.
Для диагноза вариантной формы АИГ–ПСХ также используют определенный набор критериев:
• изменения желчных протоков, типичные для ПСХ, выявляемые при ЭРПХГ или МРТ-холангиографии;
• признаки АИГ по шкале диагностки ≥ 15 баллов;
• выявление АНА или АГМ в титре ≥1 : 40;
• обнаружение ступенчатых некрозов,лимфоцитарных розеток, умеренного или выраженного перипортального или перисептального воспаления.Для дифференциального диагнозаАИГ с синдромом холестаза и вариантной формы АИГ–ПСХ определенноезначение имеют степень повышенияЩФ сыворотки крови и соотношениеЩФ и АСТ. В случае АИГ с синдромомхолестаза соотношение ЩФ/АСТ непревышает 1,5. При показателе выше1,5 более вероятен диагноз ПСХ.
Иммуносупрессивная терапия АИГ
Как уже говорилось, АИГ стал первым заболеванием, при котором иммуносупрессивное лечение привело к увеличению выживаемости. Преднизолон в монотерапии или в комбинации с азатиоприном является стандартом лечения АИГ на протяжении нескольких десятилетий и эффективен у 80 % больных. При обострении АИГ (АЛТ ≥ 10 норм, γ-глобулины сыворотки ≥ 2 норм) используются высокие дозы преднизолона – 60 мг/сут с плавным снижением до поддерживающих 5–10 мг/сут через 6 недель. В отсутствие ответа – увеличение дозы стероидов или комбинация с азатиоприном (1–1,5 мг/кг/сут). Возможно сразу начинать комбинированное лечение. Для поддержания ремиссии проводится лечение минимальной дозой стероидов (можно в комбинации с азатиоприном) не менее 12 месяцев или монотерапия азатиоприном (2–4 мг/кг/сут) 2–4 года [1, 3, 6, 13]. Альтернативой иммуносупрессивнойтерапии является второе поколение кортикостероидов – будесонид в дозе 9 мг/сут, позволяющий достигать ремиссии у большинства больных АИГ, не ответивших на стандартную иммуносупрессивную терапию [12]. Особенно перспективной оказалась комбинированная терапия будесонидом 9 мг/сут и азатиоприном 100 мг/сут. Все новые иммуносупрессивные агенты, разработанные в трансплантологии, могут быть применены при АИГ только при условии отсутствия ответа на стандартную терапию.
Лечение вариантных форм АИГ–ПБЦП и АИГ–ПСХ не стандартизировано. В лечении вариантнойформы АИГ–ПБЦП рекомендовано ориентироваться на показатели ЩФ. При уровне ЩФ ≤ 2 норм предпочтение отдается кортикостероидам или комбинации кортикостероидов и азатиоприна. При уровне ЩФ ≥ 2 норм используют кортикостероиды и урсодезоксихолевую кислоту (УДХК (Урсофальк)) в дозе 13–15 мг/кг/сут. Если доминируют признаки ПБЦП, а признаки АИГ минимальны – проводится монотерапия УДХК (Урсофальк) 13–15 мг/кг/сут.
При первом варианте перекрестного синдрома АИГ–ПБЦП преднизолон используется в максимальной суточнойдозе 60 мг в течение недели, затем по40 мг в течение недели и затем по 30 мг2 недели, после чего пациента переводят на поддерживающую дозу 20 мг/сут. Терапию начинают в комбинации с УДХК (Урсофальк) 13–15 мг/сут.Как и при АИГ, при первом вариантеперекрестного синдрома АИГ–ПБЦПможно начать лечение с комбинациипреднизолона, азатиоприна и УДХК(Урсофальк). Начальная доза преднизолона составляет 30 мг в течение1-й недели, затем 20 мг в течение 1-йнедели, затем 15 мг 2 недели с переводом на поддерживающую дозу 10мг/сут. Стартовая доза азатиоприна100 мг/сут в течение недели и затем –50 мг/сут постоянно. Доза УДХК(Урсофальк) стабильна – 13–15 мг/сут.При втором варианте синдрома АИГ–ПБЦП проводится монотерапия УДХК(Урсофальк) в суточной дозе 13–15 мг/кг. Появились пилотные исследования по применению будесонида при вариантных формах АИГ–ПБЦП и АИГ–ПСХ, что индуцировало полную ремиссию при синдроме перекреста. Рекомендована следующая схема терапии будесонидом при вариантных формах АИГ.
АИГ–ПБЦП: ЩФ ≤ 2 норм – будесонид (Буденофальк) 6–9 мг/сут; ЩФ ≥2 норм – будесонид (Буденофальк) 6–9мг/сут + УДХК (Урсофальк) 13–15 мг/кг/сут.
АИГ–ПСХ: ЩФ ≤ 2 норм – будесонид (Буденофальк) 6–9 мг/сут; ЩФ ≥2 норм – УДХК (Урсофальк) 15–20 мг/кг/сут.
Длительность терапии от 2–3 лет до пожизненного приема.
Ортотопическая трансплантация печени при АИГ
В большинстве случаев успешнаяиммуносупрессия позволяет обеспечивать длительную выживаемостьбольных АИГ и редко требует трансплантации печени. В конечной стадии АИГ трансплантация печени сохраняет высокую выживаемость больных и не угрожает их жизни. Несмотря на то что АИГ может рецидивировать в трансплантате, долгосрочная выживаемость значительно лучше, чем при других
заболеваниях печени. В будущем втрансплантологии реальна иммуносупрессия без кортикостероидов, однако эффективная иммуносупрессия с использованием стероидов остается необходимой для предотвращениясерьезного рецидива аутоиммунногозаболевания печени. Будучи эффективным методом лечения, ортотопическаятрансплантация печени по поводу АИГостается очень привлекательной дляисследований. Взаимодействие донорского органа с иммунной системойхозяина и его костным мозгом приводит к весьма интенсивному химеризму. Через годы “чужая” донорская печень становится “своей”. Значительное количество гепатоцитов донорской печени замещается печеночными клетками хозяина, в большинстве случаев, вероятно происходящих из стволовых клеток костного мозга хозяина. Микроокружение в печени после трансплантации может иметь значение при рецидиве болезни или потере толерантности к пересаженному органу. В этом свете весьма важным представляется факт развития АИГ de novo в донорской печени. Изучение этогофеномена может дать дополнительные ключи к пониманию событий, лежащих в основе потери толерантности и аутоиммунного процесса, направленного против собственных тканей.




