Ротавирусная инфекция (РВИ) считается наиболее частой причиной диареи в детском возрасте. По оценкам экспертов ВОЗ, практически каждый ребенок в течение первых трех–пяти лет жизни переносит РВИ независимо от расы и социально-экономического статуса [1]. Актуальность данной проблемы определяется не только чрезвычайно широкой распространенностью ротавируса в популяции, но и довольно тяжелым течением заболевания с развитием эксикоза различной степени, нарушений ферментации углеводов, дисбиоза кишечника, высоким риском осложнений (гиповолемический шок, поражение ЦНС и др.), а также возможностью внутрибольничного инфицирования, что приводит к ухудшению состояния больного и увеличению сроков его госпитализации.
Основные патогенетические механизмы развития осмотической диареи при РВИ в настоящее время хорошо известны: прямое цитопатическое действие ротавируса на энтероциты, влияние энтеротоксина, вторичная дисахаридазная (главным образом лактазная) недостаточность и нарушение функций индигенной микрофлоры желудочно-кишечного тракта (ЖКТ), в первую очередь касающихся синтеза короткоцепочечных летучих жирных кислот [2]. Однако недостаточно изученным остается действие ротавируса на иммунную систему, что может иметь значение в отношении последующего формирования внекишечных проявлений заболевания, хронизации инфекции, ее рецидивов, а также являться триггером возникновения аутоиммунного поражения ЖКТ. В свою очередь определение особенностей иммуногенеза РВИ позволит теоретически обосновать возможность назначения иммунопрепаратов для лечения детей с этим заболеванием.
Так, например, известно, что при острых кишечных инфекциях (ОКИ) бактериальной этиологии иммунологические сдвиги характеризуются снижением фагоцитарной активности нейтрофилов и уменьшением содержания общего IgM в сыворотке крови [3]; при иерсиниозе отмечается дефицит CD3- и CD4-лимфоцитов с повышением содержания CD8-субпопуляции [4]; при ОКИ, вызванных условно-патогенной флорой, наблюдается снижение количества иммунорегуляторных клеток и IgG с одновременным увеличением уровня IgM [5]. Все ОКИ независимо от этиологии заболевания, как правило, протекают на фоне местной иммуносупрессии и дефицита IgAs, который связывается с патогенными и условно-патогенными микроорганизмами как вирусного, так и бактериального происхождения и препятствует их адгезии на эпителиоцитах кишечника [6].
Особенности функционирования иммунной системы в детском возрасте не позволяют в должной мере защищать слизистую оболочку ЖКТ и организм ребенка в целом от воздействия патогенных микроорганизмов. Доказано, что на протяжении нескольких лет после рождения иммунитет остается несовершенным: у детей количество плазмоцитов, синтезирующих IgAs, приближается к аналогичному показателю взрослых только ко второму году жизни, а содержание мукозального IgA – лишь к 6–8 годам. Созревание иммунной системы новорожденного происходит под влиянием контактов с пищевыми и бактериальными антигенами, в т.ч. с антигенами нормальной индигенной микрофлоры ЖКТ, обладающими иммуномодулирующим действием [7].

Между состоянием иммунитета и микробным пейзажем существует тесная взаимосвязь, что подтверждается соответствующими лабораторными исследованиями и согласуется с клиническими данными. Бифидобактерии и лактобациллы способствуют синтезу таких факторов иммунной защиты, как лизоцим, пропердин, комплемент, IgAs, активируют фагоцитоз, системы цитокинов и интерферонов [8]. Установлено, что при дисбактериозе I–II степеней происходит активация местного иммунитета (повышается уровень IgA и лизоцима в копрофильтратах), тогда как при дисбиозе III степени эти иммунные механизмы истощаются, а также снижается концентрация общих IgA и IgG в сыворотке крови, угнетается фагоцитарная активность лейкоцитов.
Для коррекции указанных иммунологических нарушений при ОКИ вирусной этиологии наряду с пробиотиками представляется целесообразным использование препаратов интерферона, которые оказывают иммуномодулирующее и противовирусное действия, положительно влияют на динамику клинических проявлений заболевания [9]. Одним из широко применяемых препаратов данной группы в настоящее время является Виферон – рекомбинантный интерферон-α-2b, выпускаемый в виде ректальных суппозиториев, что удобно для применения в детской практике.
Исходя из изложенного, целью настоящей работы стало определение особенностей иммунного статуса и эффективности иммунотерапии при РВИ у детей.
Материал и методы исследования
Работа проведена на базе 4-го инфекционного отделения ГБУЗ «Тушинская ДГБ» ДЗ Москвы (главный врач – проф. И.М. Османов). Были обследованы 145 детей в возрасте от 5 месяцев до 14 лет с ОКИ, протекающими по типу водянистой диареи. Из них детей первого года жизни было 10,3%, в возрасте 1–3 лет – 29,0%, старше 3 лет – 60,7%; мальчиков – 74 (51%), девочек – 71 (49%). Все пациенты были госпитализированы в первые-вторые сутки от начала заболевания, в анамнезе у них отсутствовали пищевая аллергия, лактазная недостаточность, а также факт приема пробиотиков и иммуномодуляторов непосредственно перед настоящим эпизодом ОКИ.
Всем детям проведено общеклиническое обследование, включившее сбор жалоб и анамнеза, осмотр в динамике, исследование крови и мочи, биохимический анализ крови, бактериологический посев кала на кишечную группу, копрограмму, по показаниям – ультразвуковое исследование органов брюшной полости, консультацию хирурга для исключения «острого живота». Кроме того, с целью этиологической расшифровки заболевания методом иммуноферментного анализа (ИФА) определен антиген ротавируса в кале всех пациентов на базе бактериологической лаборатории Тушинской ДГБ, а также РНК рота-, норо- и астровирусов в копрофильтратах методом полимеразной цепной реакции на базе ГУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН.

Иммунологическое обследование всем детям проведено на 1–2-й и 5–6-й дни госпитализации с целью динамического мониторинга за состоянием иммунного статуса. Исследования выполнены на базе лаборатории онтогенеза и коррекции системы интерфероногенеза ГУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН и в Центре иммунокоррекции ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. академика В.И. Шумакова» Минздрава России.
В сыворотке крови больных методом ИФА с помощью тест-систем производства «Biosourse» (Бельгия) и «Протеиновый контур» (Санкт-Петербург, Россия) определено содержание провоспалительных цитокинов (интерлейкинов [ИЛ]-1β, -6 и -8, фактора некроза опухоли-α, интерферонов-α и -γ) и способность к продукции иммунокомпетентными клетками интерферонов-α и -γ in vitro. Исследованы также параметры фагоцитарной активности нейтрофилов (фагоцитарное число и фагоцитарный индекс) по методу Р.В. Петрова с использованием убитой взвеси Staphylococcus aureus, уровень общих иммуноглобулинов (Ig) A, M, G в сыворотке крови по методу G. Manchini и концентрация IgA в копрофильтратах методом радиальной иммунодиффузии.
Все пациенты получали стандартное лечение пероральными регидратационными растворами, энтеросорбентами, ферментными препаратами в возрастных дозах, при необходимости проводилась инфузионная терапия глюкозо-солевыми растворами, назначались жаропонижающие средства. Дополнительно к базисному лечению 33 ребенка (1-я группа) получали пробиотик Бифиформ Малыш (Ферросан, Дания), содержащий штаммы ВВ12 и LGG в возрастных дозах в течение 5 дней; 34 детям (2-я группа) вводили ректально Виферон, основным действующим веществом которого является интерферон-α-2b, по 1 свече дважды в день курсом 5 дней (в возрасте до 7 лет по 150 тыс. МЕ, старше 7 лет – по 500 тыс. МЕ); 35 пациентов (3-я группа) получали комбинированное лечение Бифиформом Малыш и Вифероном; 43 ребенка составили контрольную, 4-ю, группу, которым назначалась только базисная терапия. Группы формировались методом случайной выборки и оказались сопоставимыми по возрасту, степени тяжести заболевания, типу диареи и топике поражения ЖКТ.
Статистическая обработка полученных результатов проведена с помощью пакета программ «Statistica 6.1» с использованием параметрического t-критерия Стьюдента и непараметрических критериев Вилкоксона, Уитни–Манна и Фишера.
Результаты и их обсуждение
Этиологию ОКИ удалось установить в отношении 81,4% больных, в т.ч. для 53,8% детей причиной заболевания оказался ротавирус, для 9,7% – норовирус, для 3,4% – астровирус; в 9,7% случаев зарегистрирована микст-вирусная инфекция и для 4,8 % пациентов причиной ОКИ был сальмонеллез. Диарея осмотического типа отмечена у 109 (75,2%) детей, секреторного – у 13 (8,9 %), инвазивного – у 12 (8,3%), а у 11 (7,6%) пациентов заболевание протекало без диареи. По топике поражения ЖКТ чаще всего регистрировался гастроэнтерит – 76,6%.
ОКИ протекала в легкой форме у 9 (6,2%) больных, в среднетяжелой – у 119 (82,1 %), в тяжелой – у 17 (11,7%).
Длительность лихорадки оказалась достоверно менее продолжительной при легком течении заболевания по сравнению со среднетяжелыми и тяжелыми формами: 1,22±0,83, 2,32±1,18 и 3,17±1,07 суток соответственно (р<0,05 по t-критерию Стьюдента). Рвота также была менее продолжительной у больных с легким течением относительно пациентов с тяжелым течением ОКИ: 1,22±0,66 против 2,05±0,96 суток (р<0,05). Диарея длилась достоверно меньше при легких формах заболевания по сравнению со среднетяжелыми и тяжелыми: 2,0±1,0, 3,68±1,62 и 4,64±1,27 суток соответственно (р<0,01). Метеоризм наблюдался при осмотическом типе диареи у 85,3% детей, при секреторном – у 69,2%, при инвазивном – у 75,0%, тогда как в отсутствие диарейного синдрома он встречался лишь у 27,7% больных.
Токсикоз с эксикозом различной степени развивался у 79,8% детей с осмотической диареей, у 76,9% – с секреторной, у 83,3% – с инвазивной диареей и только у 54,6% пациентов без диареи. В зависимости от топики поражения ЖКТ токсикоз с эксикозом чаще (в 75–80% случаев) отмечался при гастроэнтеритах, энтероколитах и гастроэнтероколитах, тогда как при гастритах обезвоживание наблюдалось реже (у 55% больных). В целом длительность эпизода ОКИ при легком течении составила в среднем 3,55±0,72 суток, что достоверно короче относительно среднетяжелых и тяжелых форм: 5,18±1,3 и 6,23±1,09 суток соответственно (р<0,001 по t-критерию Стьюдента). Среди всех клинических форм достоверно наименее продолжительным оказалось течениегастрита (3,8±0,6 суток) по сравнению с другими топическими диагнозами «гастроэнтерит», «энтероколит» и «гастроэнтероколитом»: 5,2±1,3, 6,0±2,0 и 5,7±1,1 суток соответственно (р<0,05).
Результаты проведенных иммунологических исследований показали, что в остром периоде ОКИ независимо от типа диареи в сыворотке крови у 70,6% больных снижался уровень IgA в среднем до 0,71±0,45 г/л (норма – 0,93± 0,3 г/л) и у 94,1 % пациентов повышался уровень IgМ в среднем до 1,3±0,74 г/л (норма – 0,56±0,2 г/л), тогда как содержание IgG у 94,1% детей оставалось в пределах нормальных значений и составило в среднем 8,55±2,99 г/л. Указанные изменения свидетельствуют об активации гуморального звена иммунитета в остром периоде заболевания в ответ на антигенную стимуляцию. В период ранней реконвалесценции наблюдалось спонтанное повышение концентрации IgA в сыворотке крови всех пациентов в среднем до 1,09±0,63 г/л при сохранении высокой концентрации IgМ и нормальной концентрации IgG (табл. 1).
Эти изменения коррелировали со снижением уровня IgAs в копрофильтратах – с 0,58 до 0,42 мг/мл, что отражает процесс купирования местной воспалительной реакции в кишечнике на фоне формирования гуморального иммунного ответа.
У 77,8% детей выявлено снижение фагоцитарного индекса в среднем до 40% при норме 50–70% и у 100% больных – снижение фагоцитарного числа до 3 микробных тел при норме 4–7. При РВИ дефицит фагоцитоза коррелирует со слабой системной продукцией интерферонов-α и -γ, что, вероятно, обусловлено иммуносупрессивным действием ротавируса в остром периоде заболевания [10]. В динамике у 72,8% пациентов фагоцитарный индекс в среднем достигал нижних значений нормы (49,5%), тогда как фагоцитарное число сохранялось на низком уровне – 3,1 (табл. 1). Подобные изменения свидетельствуют о дефиците клеточного звена иммунитета.
При исследовании цитокинового статуса анализировалась продукция провоспалительных ИЛ-1β, ИЛ-6, ИЛ-8, фактора некроза опухоли-α, являющихся медиаторами клеточного звена иммунитета, а также интерферонов-α и -γ – спонтанных и индуцированных. Показано, что в остром периоде РВИ отмечено повышение содержания в сыворотке крови ИЛ-1β и ИЛ-6 до 272,18 и 86,9 пкг/мл соответственно, тогда как содержание ИЛ-8 и фактора некроза опухоли-α не превышало ординарных значений – 27,7 и 32,0 пкг/мл соответственно (норма для всех показателей – до 50 пкг/мл). В период ранней реконвалесценции наблюдалось отсутствие существенной динамики в уровне фактора некроза опухоли-α, ИЛ-6 и -8, тогда как уровень ИЛ-1β достоверно возрастал по сравнению с острым периодом заболевания и достигал 357,85 пкг/мл (табл. 2), что отражает степень местной воспалительной реакции в ЖКТ и активацию антителообразования.
В первые-вторые сутки заболевания количество сывороточных интерферонов-α и -γ сохранялось в пределах нормы (соответственно 19,05 и 12,0 пкг/мл при норме до 50 пкг/мл), тогда как количество индуцированных интерферонов-α и -γ оказалось сниженным до 63,45 и 508,2 пкг/мл соответственно (норма – 100–500 и 1000–5000 пкг/мл), что свидетельствовало о недостаточности противовирусного иммунитета в ответ на нагрузку антигенами ротавируса [11]. При динамическом исследовании существенных изменений количества данных цитокинов не произошло: уровни сывороточных интерферонов-α и -γ не превышали нормальных значений, а содержание индуцированных интерферонов-α и -γ оставалось сниженным у 75,2 и 80,4% детей соответственно. Сохранение в период ранней реконвалесценции дефицита индуцированных интерферонов-α и -γ говорит о низком интерфероногенезе и длительности иммуносупрессии.
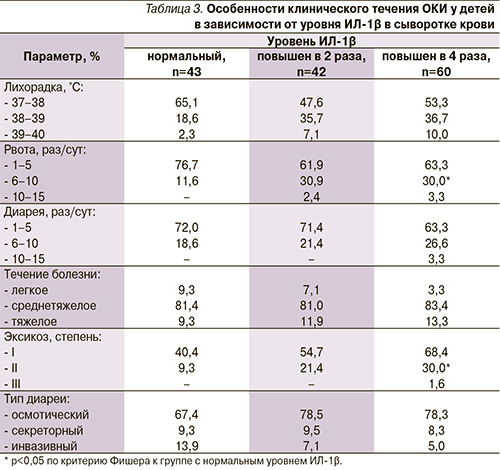
Поскольку наиболее выраженные нарушения из всех изучаемых иммунологических показателей отмечены со стороны ИЛ-1β, нами была проанализирована клиническая картина РВИ у детей в зависимости от уровня этого цитокина (табл. 3). У больных с высоким уровнем ИЛ-1β достоверно чаще наблюдались рвота (6–10 раз/сут) и токсикоз с эксикозом II степени – 30 против 11,6% и 30 против 9,3% соответственно (р<0,05 по критерию Фишера), что позволяет рассматривать данный цитокин в качестве маркера синдрома интоксикации в остром периоде РВИ. Подтверждает этот факт то обстоятельство, что высокий уровень ИЛ-1β выявлен у пациентов всех возрастных групп и при любом течении заболевания, однако степень его повышения оказалась при этом разной. Так, у детей в возрасте старше 7 лет диапазон уровня ИЛ-1β в сыворотке крови был значительно шире, чем у детей младшего возраста, и колебался в пределах 123–2073 пкг/мл. При легком течении РВИ уровень данного цитокина повышался в 2–4 раза выше нормы (в среднем 201,56 пкг/мл), при среднетяжелом течении – в 4–6 (в среднем 304,27 пкг/мл) и при тяжелом течении – в 6–8 раз (в среднем 406,97 пкг/мл).
Выявленные отклонения в цитокиновом статусе у детей с РВИ послужили обоснованием включения иммунотерапии в комплекс лечебных мероприятий при данной нозологии. У детей 1-й группы, получавших Бифиформ Малыш, достоверных различий в выраженности и длительности различных симптомов заболевания не наблюдалось, однако было отмечено положительное влияние этого пробиотика на показатели иммунитета: достоверно повышались фагоцитарный индекс, фагоцитарное число и уровень сывороточного IgA (р<0,05 по t-критерию Стьюдента). Уровень IgМ в сыворотке крови хотя и оставался повышенным, но был достоверно ниже аналогичного показателя в контрольной группе.
У пациентов 2-й группы, находившихся на базисной терапии в сочетании с Вифероном, достоверно быстрее купировались симптомы интоксикации по сравнению с 4-й (контрольной) группой (р<0,05 по t-критерию Стьюдента). При этом в 2 раза нарастало содержание интерферонов-α и -γ у 37,5 и 46,1% больных соответственно, что превосходило показатели контрольной группы, хотя эти различия не были достоверными, что объясняется низкой интерфероногенной активностью ротавируса в остром периоде заболевания [11].
У детей 3-й группы, получавших наряду с базисным лечением Бифиформ Малыш и Виферон, как и во 2-й группе, зарегистрировано достоверное ослабление симптомов интоксикации относительно контроля, а также отмечена положительная динамика иммунологических показателей: снижение уровня провоспалительного цитокина ИЛ-6 и повышение содержания индуцированного интерферона-γ до нормы у 66,7% пациентов по сравнению с 4-й группой (р<0,001).
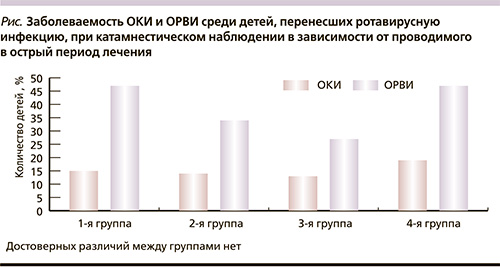
Длительность заболевания во всех группах составила в среднем 5 суток, таким образом, существенного влияния ни один из изучаемых способов лечения на продолжительность РВИ у детей не оказывал. Однако, несмотря на клиническое выздоровление к этому сроку, полной нормализации показателей клеточно-опосредованного противовирусного иммунитета и интерфероногенеза не происходит. Катамнестическое наблюдение в течение 6 месяцев за 74 пациентами, перенесшими РВИ, показало, что дети, получавшие в остром периоде Виферон и комбинацию Виферона с Бифиформом Малыш в отличие от пациентов, находившихся лишь на базисной терапии или лечившихся по стандарту в сочетании с пробиотиком, в 1,5 раза реже болели острыми респираторными вирусными инфекциями (ОРВИ; см. рисунок). При этом заболевание у них протекало в легкой и среднетяжелой формах: соответственно у 53,2 и 46,8% детей.
Выводы
Острый период ОКИ независимо от типа диареи характеризуется активацией гуморального звена иммунитета в ответ на антигенную стимуляцию, что выражается в снижении уровня сывороточного IgA и повышении уровня IgМ, а также дефиците клеточного звена иммунитета, проявляющемся снижением показателей фагоцитоза.
В период ранней реконвалесценции ОКИ при повышении в сыворотке крови концентрации IgA и сохранении высокой концентрации IgМ снижается уровень IgAs, что свидетельствует о купировании местной воспалительной реакции в кишечнике на фоне формирования гуморального иммунного ответа.
Из всех провоспалительных цитокинов как в остром периоде заболевания, так и период ранней реконвалесценции наиболее выраженное повышение содержания отмечается для ИЛ-1β, что может рассматриваться как маркер синдрома интоксикации в остром периоде РВИ.
Иммуносупрессивное действие ротавируса подтверждается снижением уровня индуцированных интерферонов-α и -γ на протяжении всего течения инфекции, что служит обоснованием включения иммунотерапии в комплекс терапевтических мероприятий для больных РВИ.
Применение пациентами с РВИ наряду с базисным лечением Виферона, содержащего интерферон-α-2b, и комбинации Виферона с пробиотиком Бифиформ Малыш способствует положительной клинико-иммунологической динамике в остром периоде заболевания, а также в 1,5 раза снижает частоту ОРВИ у детей при катамнестическом наб-людении в течение 6 месяцев.



