Введение
Рак молочной железы (РМЖ) на протяжении многих десятилетий занимает лидирующие позиции в заболеваемости и смертности среди женщин по всему миру. По данным Всемирной организации здравоохранения, в 2020 г. было зарегистрировано свыше 2,2 млн случаев этого заболевания и около 685 тыс. женщин умерли от РМЖ [1]. Несмотря на это, успехи в системном лечении РМЖ, раннее выявление опухоли, в т.ч. благодаря скрининговым мероприятиям, а также более глубокое понимание биологии злокачественного процесса позволили снизить смертность от РМЖ в странах с высоким уровнем дохода на 40% за период с 1980-х до 2020 г. [1]. Успех в лечении РМЖ складывается из нескольких аспектов, важнейшими из которых являются выявление опухоли на ранних стадиях, а также обоснованное сочетание локальных и системных методов лечения. Благодаря стремительному развитию и применению лекарственной терапии РМЖ удалось существенно снизить риск прогрессирования заболевания и улучшить долгосрочную выживаемость больных по сравнению с использованием только локальных методов лечения, таких как хирургическое лечение и лучевая терапия. Согласно существующим представлениям о развитии онкологического процесса, остаточные опухолевые клетки, или микрометастазы, попадая в кровоток, служат причиной отдаленного метастазирования. Основной целью системного адъювантного лечения является элиминация этих остаточных клеток, оставшихся после локального лечения, не определяемых ни визуально, ни рентгенологически. Согласно проведенному мета-анализу 194 рандомизированных исследований с 1985 по 2000 г. антрациклин-содержащая адъювантная полихимио-терапия снижает годовой уровень смертности от РМЖ примерно на 38% для женщин моложе 50 лет и примерно на 20% для пациенток в возрасте 50–69 лет на момент постановки диагноза [2]. Адъювантная химиотерапия (АХТ) на протяжении многих лет применяется при раннем и местнораспространенном РМЖ как дополнение к хирургическому и лучевому этапам лечения.
С течением времени применяемые химиопрепараты и схемы лечения существенно менялись, неоднократно пересматривались кратность и интервалы между циклами. Однако и по сей день остается актуальным вопрос о допустимом интервале между операцией и началом АХТ. В большинстве случаев врачи предпочитают начинать АХТ в течение 4–6 недель после операции. Считается, что более длительный интервал начала химиотерапии (ХТ) после операции может снижать эффективность системного лечения. Представление о том, что отсрочка проведения АХТ связана с неблагоприятными исходами, подтверждается доклиническими данными, которые выявили фазу ускоренного роста микроскопической остаточной болезни после первичного хирургического лечения [3, 4], а также математическими моделями, демонстрирующими развитие резистентности к ХТ [5]. Исследования на животных моделях также показали, что хирургическое вмешательство может увеличивать число циркулирующих опухолевых клеток и онкогенных факторов роста, а также ускорять рост метастазов [6, 7].
Несмотря на данные проведенных исследований, оптимальное время проведения ХТ больным РМЖ на сегодняшний день точно не установлено. В нескольких исследованиях были предприняты попытки оценить роль отсроченного начала ХТ на выживаемость, но результаты оказались противоречивыми [8]. Развитие послеоперационных осложнений, необходимость повторных операций при «позитивных» краях резекции, общее состояние больного и другие факторы могут отсрочивать начало ХТ после операции, поэтому определение максимально возможных сроков проведения ХТ, а также сопряженных с этим рисков поможет планировать лечение пациентки более персонализированно и безопасно.
Возможные причины отсроченного начала АХТ
Одной из наиболее распространенных причин отсроченного начала ХТ является тип операции, проведенной пациентке в рамках хирургического этапа лечения. A.R. Kupstas et al. (2019) ретроспективно проанализировали данные с 2010 по 2014 г. по влиянию типа хирургического вмешательства на время до начала АХТ, а также влиянию отсроченного начала ХТ на выживаемость пациенток с I–III стадиями РМЖ. В исследовании была выявлена связь между типом операции и временем начала ХТ: в группе пациенток, перенесших органосохраняющую операцию, среднее время до начала АХТ составило 43 дня, в группе с одномоментной реконструкцией собственными тканями – в среднем 45 дней, а у пациенток с одномоментной реконструкцией имплантами – 44 дня (p<0,001) [9]. При анализе времени от постановки диагноза до начала ХТ также были выявлены статистически значимые различия: в подгруппе пациенток, перенесших органосохраняющую операцию, среднее время до начала ХТ составило 71 день, в то время как в подгруппе пациенток после мастэктомии – 78 дней (p<0,001). Пациентки после органосохраняющих операций с меньшей вероятностью имели задержку начала ХТ: 8,3% начали ХТ позже, чем через 120 дней после постановки диагноза, по сравнению с 12,9% в группе мастэктомии (p<0,001). У пациенток с одномоментной реконструкцией время до начала ХТ было более продолжительным (в среднем 84 дня). При оценке типа реконструкции у 16% пациенток, перенесших реконструкцию собственными тканями, отмечалась задержка начала ХТ по сравнению с 13,3% пациенток, перенесших реконструкцию на основе имплантов (р<0,001). В исследовании A. Downing et al. (2014) также было выявлено влияние типа хирургического лечения на начало ХТ: женщины, которым была проведена одномоментная реконструкция, ждали дольше, прежде чем начать АХТ, чем те, кому реконструкция не была проведена (5,8 дня против 2,4 дня) [10]. Такие различия во времени начала ХТ у пациенток разных групп в зависимости от типа хирургического лечения, по всей видимости, ассоциированы с более долгим реабилитационным периодом после операции и заживлением послеоперационной раны.
Помимо типа хирургического лечения на задержку начала АХТ также может влиять возраст пациентки.
A. Downing et al. (2014) выявили связь между возрастом пациентки и сроками начала АХТ: начало ХТ пропорционально задерживалось с увеличением возраста пациентки (около 1 дня дополнительного ожидания на каждые 5 лет) [10]. Такие результаты могут быть ассоциированы с более частым наличием коморбидных состояний у пожилых пациенток, а также более длительной реабилитацией после перенесенной операции.
Социально-экономический статус пациентки играет роль в ее приверженности лечению и, соответственно, также может оказывать влияние на сроки начала проведения адъювантного лечения. В обсервационном популяционном исследовании M. Chavez-MacGregor et al. (2016), включившем 24 843 пациентки с I–III стадиями РМЖ, установлено, что начало АХТ у пациенток с низким доходом или не имевших медицинской страховки, а также у пациенток, не состоявших в браке, с большей вероятностью будет задержано более чем на 91 день (отношение рисков [ОР]=1,15, 95% доверительный интервал [ДИ]: 1,03–1,29) [11]. Подобно этому исследованию, Z.Z. Nurgalieva et al. (2013) также отмечают афроамериканскую расу или латиноамериканскую этническую принадлежность как значимый фактор, связанный с задержкой начала ХТ, что, по-видимому, ассоциировано в среднем с более низким социально-экономическим статусом пациенток данной группы [12].
Интересно отметить, что в большинстве проведенных исследований у пациенток с более агрессивными молекулярными подтипами опухоли, такими как трижды негативный и HER2-позитивный, с меньшей вероятностью была зарегистрирована задержка начала ХТ. Такие наблюдения, по всей вероятности, связаны со склонностью лечащих докторов максимально быстро начинать системное лечение ввиду агрессивности опухоли (табл. 1).

Оценка последствий отсроченного начала АХТ
АХТ на протяжении нескольких десятилетий является одним из наиболее важных этапов в лечении РМЖ. Представление о РМЖ как о системном заболевании позволило выработать новые алгоритмы лечения и существенно улучшить выживаемость пациенток. Выявление оптимальных и безопасных сроков начала АХТ является приоритетной задачей исследователей, однако результаты большинства проведенных исследований не так однозначны. Многоцентровое рандомизированное исследование A. Farolfi et al. (2015) с участием 1066 пациенток с I–III стадиями РМЖ показало, что более длительный временной интервал от радикального хирургического лечения до начала АХТ приводил к значительному увеличению риска прогрессирования заболевания (ОР=1,15, 95% ДИ: 1,02–1,30; p=0,019) [13]. Исследователи пришли к выводу, что лучшее время для послеоперационной АХТ составляет первые 7 недель после хирургического лечения (p=0,043): 8-летняя общая выживаемость (ОВ) для пациенток, получивших АХТ в течение 7 недель, составила 88% (95% ДИ: 85–90) и 78% (95% ДИ: 68–87) для пациенток, ожидавших более 7 недель.
В исследовании C. Shannon et al. (2003) был выбран более короткий временной промежуток до начала ХТ.
В исследование был включен 1161 пациент, получавший АХТ по поводу раннего РМЖ [14]. Результаты показали, что не было существенных различий в ОВ и безрецидивной выживаемости (БРВ) между пациентками, получившими ХТ в течение 3 недель после хирургического лечения (368 пациенток), и теми, кто получил ХТ после 3 недель (793 пациентки). Важно отметить, что в группе ХТ после 3 недель 75% пациенток получили лечение с 21-й по 35-й день после операции.
Похожие результаты были получены в ретроспективном исследовании, проведенном C. Sanchez et al. (2007), в которое были отобраны 2782 пациентки с I–III стадиями РМЖ, получавших лечение с 1990 по 1997 г. [15]. Были собраны данные о прогностических факторах, таких как возраст, размер опухоли, инвазия сосудов (кровеносных и лимфатических), гистологическая степень злокачественности, статус лимфатических узлов, экспрессия гормональных рецепторов и проведение гормональной терапии. Исследователи не выявили различий в 5-летней выживаемости пациенток, начавших ХТ в сроки менее 3 недель, в течение 3–6 недель, в течение 6–9 недель и более 9 недель после операции. Но, как отмечают авторы исследования, их результаты могут не отражать всех последствий задержки ХТ в связи с недостаточной статистической мощностью исследования и неоднородностью анализируемых схем ХТ, поэтому адъювантное системное лечение не следует откладывать на неопределенный срок без обоснованных причин, т.к. задержка в начале АХТ может повлечь негативные последствия для любой подгруппы пациентов.
В крупном популяционном исследовании Датской группы по борьбе с РМЖ (2005) 7501 пациентке с РМЖ проводилась ХТ в течение 3 месяцев после операции в период с 1977 по 1999 г., из них 6417 пациенток получали ХТ по схеме CMF (циклофосфамид, метотрексат, 5-фторурацил) и 1084 – по схеме CEF (циклофосфамид, эпирубицин, 5-фторурацил). По времени начала АХТ пациентки были стратифицированы в 4 группы: через 1–3 недели, через 4, через 5 и через 6–13 недель. Исследование не продемонстрировало каких-либо преимуществ в отношении ОВ от раннего начала АХТ [16]. Однако необходимо отметить, что авторы не смогли оценить эффект отсрочки более чем на 90 дней, поскольку 98% пациенток получали АХТ в течение 3 месяцев после операции.
В популяционном исследовании M. Chavez-MacGregor et al. (2016) помимо влияния социально-экономического статуса пациенток на сроки начала АХТ также исследовалось влияние задержки лечения на ОВ и БРВ [11]. В исследовании было выявлено, что пациентки, пролеченные через 91 или более дней после операции, имели худшую ОВ (ОР=1,34; 95% ДИ: 1,15–1,57) и худшую онкоспецифическую выживаемость (ОР=1,27; 95% ДИ: 1,05–1,53). При подгрупповом анализе в соответствии с молекулярным подтипом опухоли более длительная задержка привела к тому, что пациентки с трижды негативным РМЖ имели худшую ОВ (ОР=1,53; 95% ДИ: 1,17–2,00) и худшую онкоспецифическую выживаемость (ОР=1,53; 95% ДИ: 1,17–2,07). Данное исследование показало, что у пациенток, получивших АХТ позже 12 недель после операции, риск смерти от РМЖ увеличился на 27%, а риск смертности от всех причин на 34%. На каждые 4 недели задержки АХТ смертность увеличивалась на 4%.
В мета-анализе данных 34 097 пациенток с верифицированным РМЖ с 1978 по 2013 г., проведенном K.D. Yu et al. (2013), выявлено, что 4-недельное увеличение времени проведения АХТ было связано со значительным снижением как ОВ, так и БРВ [17]. Аналогичные результаты были представлены чуть позже в исследовании M.J. Raphael et al. (2016): на каждые 4 недели задержки АХТ риск смерти пациенток увеличивался почти на 5% [18]. В мета-анализе J.J. Biagi et al. (2011), включившем 15 327 пациенток, сообщается об увеличении риска смерти на 6% на каждые 4 недели задержки начала АХТ при РМЖ (табл. 2) [19].

Влияние отсроченного начала АХТ на выживаемость в зависимости от молекулярного подтипа опухоли
Некоторые исследователи полагают, что отсрочка начала АХТ приведет к различным результатам в зависимости от подтипа РМЖ [12, 20].
D.M. Gagliato et al. (2014) ретроспективно проанализировали данные 6827 пациенток с I–III стадиями РМЖ, которые получали АХТ в MD Anderson Cancer Center в период с 1997 по 2011 г. [21]. Пациентки были разделены на 3 группы в зависимости от времени до начала ХТ: менее 30 дней, от 31 до 60 и более 61 дня. При оценке показателей выживаемости учитывались время до начала ХТ и подтип РМЖ. Начало ХТ более чем через 61 день после операции было связано с неблагоприятными исходами среди пациенток с II и III стадиями. Пациентки с трижды негативным (ТНРМЖ) и HER2-экспрессирующим подтипами опухоли, начавшие ХТ более чем через 61 день после операции, имели худшую выживаемость (ОР=1,54; 95% ДИ от 1,09 до 2,18 и ОР=3,09, 95% ДИ от 1,49 до 6,39 соответственно) по сравнению с теми, кто начал лечение в первые 30 дней после операции. Среди пациенток с I стадией РМЖ не было значимой связи между показателями выживаемости и временем начала АХТ.
Таким образом, на основании результатов исследования можно сделать вывод о том, что увеличение времени начала ХТ ухудшало показатели выживаемости у пациенток с III стадией РМЖ при трижды негативном и HER2-позитивном молекулярных подтипах опухоли.
Более значимое влияние отсрочки ХТ при агрессивных подтипах опухоли также было продемонстрировано в ряде других исследований (табл. 3).
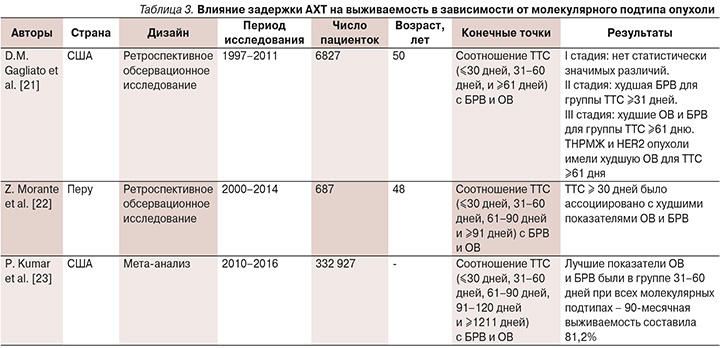
Z. Morante et al. (2021) проанализировали связь между временем начала АХТ и прогнозом больных трижды негативным РМЖ [22]. Ретроспективно были проанализированы данные 687 пациенток с трижды негативным РМЖ. По времени начала ХТ больные были разделены на 4 группы: ≤30 дней, от 31 до 60, от 61 до 90 и ≥91 дня. Средний возраст на момент постановки диагноза составил 49,1 года, и у большинства (62,6%) пациенток опухоль соответствовала Т2. Результаты показали, что ОВ и БРВ у пациенток с трижды негативным РМЖ, начавших АХТ в течение 30 дней после операции, были лучше, чем у пациенток, начавших АХТ позже 30 дней (ОР=1,86; 95% ДИ: 1,24–2,79 и ОР=3,16; 95% ДИ: 1,78–5,61 соответственно). P. Kumar et al. (2021) провели наиболее крупный мета-анализ, используя данные из Национальной онкологической базы данных США [23]. Всего были проанализированы данные 332 927 пациенток с РМЖ I–III стадий, получавших АХТ в период с 2010 по 2016 г. Пациентки были разделены на пять групп в зависимости от времени начала АХТ после хирургического вмешательства: ≤30 дней, 31–60, 61–90, 91–120 и >120 дней, а также на подгруппы в зависимости от статуса рецепторов к эстрогену, прогестерону, онкобелку HER2: трижды негативный, гормон-позитивный HER2-негативный, гормон-позитивный HER2-позитивный и гормон-негативный HER2-позитивный подтипы. Лучшие показатели выживаемости были в группе 31–60 дней при всех подтипах, за исключением гормон-позитивной HER2-негативной, где можно рассматривать более «широкое окно» начала АХТ – 31–90 дней, т.к. в группах 31–60 и 61–90 дней не было выявлено статистически значимых различий. Исследователи не выявили существенной разницы влияния отсроченной АХТ в двух подгруппах с HER2-позитивным подтипом опухоли, несмотря на то что в клинической практике известно, что они имеют различную реакцию на лечение. Задержку определяли как проведение ХТ после 60 дней с даты операции. Такой период был выбран, поскольку группа 31–60-дневного периода показала лучшие результаты при большинстве биологических подтипов. Чаще всего задержка регистрировалась при гормон-позитивном HER-негативном РМЖ, за ним следовали гормон-позитиный HER2-позитивный и гормон-негативный HER2-позитивный РМЖ, при трижды негативном подтипе задержка отмечалась реже. При оценке 90-месячной выживаемости по кривым выживаемости Kaplan–Meier исследователи получили следующие результаты: в группе 31–60 дней – 81,2%, в группе 61–90 дней – 79,5%, в группе ≤30 дней – 79,2%, в группе 91–120 дней – 77,7% и в группе >120 дней – 74,4%. Оценка при скорректированном отношении рисков показала лучшую выживаемость в группе 31–60 дней, далее следовала группа 61–90 дней. В группе ≤30 дней результат был лучше, чем в группе с периодом >120 дней, и не было различий по сравнению с группой 91–120 дней. Риск для группы 31–60 дней составил 84,2% для группы <30 дней, 90% для группы 61–90 дней, 80,2% для группы 91–120 дней и 71% для группы >120 дней.
Заключение
Оптимальное время для начала АХТ остается темой клинической важности. С учетом характера вопроса проспективные рандомизированные исследования не могут проводиться, поскольку будут считаться неэтичными. Имеющиеся на сегодняшний день результаты исследований довольно противоречивы, т.к. некоторые работы не выявили негативного влияния отсрочки начала АХТ. Однако эти исследования были небольшими, чаще сообщали о данных одного учреждения и не отражали современного системного лечения РМЖ. Также, по мнению некоторых авторов, начало АХТ в раннем послеоперационном периоде может приводить к плохой ее переносимости, тогда как отсрочка ее применения после определенного периода может приводить к плохим результатам выживаемости [24]. Основываясь на результатах самого крупного и качественного анализа данных, лучшие показатели выживаемости отмечались, если АХТ начинают в интервале 31–60 дней после операции при трижды негативном РМЖ, у гормон-позитивных HER2-позитивных, гормон-негативных HER2-позитивных опухолях, а в случае гормон-позитивного HER2-негативного подтипа – 31–90 дней после операции.
Необходимо отметить, что эпидемия COVID-19 усложнила стандартизированную диагностику и лечение РМЖ. Многие пациентки начинали АХТ с большой задержкой, также нередки были случаи задержек между циклами проводимой терапии. Анализ случаев этого периода позволит получить дополнительные данные о влиянии задержки начала АХТ, при этом уже с оценкой современных схем терапии.



