Связь синдрома раздраженного кишечника (СРК) с нарушениями психоэмоциональной сферы известна давно. Еще в 1889 г. Уильям Ослер, описавший это заболевание под названием “слизистый колит”, отметил, что наиболее часто оно встречается среди женщин, склонных к истерии и депрессии [15].
На современном этапе значимость психоневрологических нарушений включена в само определение СРК как биопсихосоциальной патологии, связанной с нарушением регуляции кишечных функций со стороны центральной нервной системы [18].
Несмотря на прогностически благоприятное течение, СРК ставит перед специалистами ряд серьезных проблем:
• Трудоемкая и дорогостоящая диагностика. Являясь диагнозом исключения, СРК требует проведения большого комплекса исследований, в т. ч. инвазивных, т. к. биологические маркеры заболевания отсутствуют.
• Значительное снижение качества жизни. По данным ряда авторов, снижение качества жизни больных СРК сопоставимо с таковым пациентов с язвенным колитом и болезнью Крона [17]. В некоторых исследованиях оно оценивается ниже, чем у больных сахарным диабетом [23].
• Отсутствие эффективных схем лечения. Длительной ремиссии удается добиваться менее чем для 30 % пациентов [9].
Коррекция психоэмоциональных и вегетативных нарушений при СРК входит в стандарты лечения данной патологии [1, 3, 4, 7, 12]. Многие авторы указывают на эффективность психотропной терапии при рефрактерном течении СРК, когда базовые препараты, традиционно используемые в гастроэнтерологии, оказываются неэффективными [5, 8, 13, 14].
Чаще всего в лечении СРК, как и ряда других функциональных расстройств со стороны желудочно-кишечного тракта, используются такие психотропные препараты, как антидепрессанты и нейролептики. Антидепрессанты обладают различными фармакодинамическими свойствами, основное из которых – повышение патологически сниженного настроения, однако спектр действия этих препаратов очень широк, что позволяет успешно использовать их в клинике внутренних болезней [11]. В лечении СРК важную роль играет вегетостабилизирующий и соматотропный эффекты антидепрессантов, а также их противотревожное, седативное и стимулирующее действия [2].
В ряде крупных клинических исследований изучалась эффективность влияния на клинические проявления СРК следующих групп психотропных препаратов: трициклические антидепрессанты (ТЦА; амитриптилин, нортриптилин, дизипрамин, тримипрамин), тетрациклические антидепрессанты (ТРЦА; миансерин), анксиолитики (мепробамат) и нейролептики (галоперидол) [12]. В гастроэнтерологии имеется также длительный опыт применения нейролептика группы бензамидов сульпирида при различных функциональных желудочно-кишечных расстройствах [10].
Все проведенные исследования показали позитивное влияние вышеперечисленных препаратов на динамику общего состояния пациентов, болевой синдром и диарею. В некоторых исследованиях оценивалась сопряженность улучшения психоэмоционального состояния и уменьшения выраженности клинических проявлений СРК с достижением длительной ремиссии заболевания (более года) после курса лечения антидепрессантами [14]. Однако данные о корреляции уровня тревоги и депрессии с болевым абдоминальным синдромом и нарушением кишечной моторики противоречивы. В одних исследованиях указывается на способность ТЦА предотвращать рецидивы СРК с запорами [12], в других, наоборот, отмечается, что ТЦА усиливают констипацию, метеоризм, способствуют трансформации СРК с преобладанием диареи в форму с преобладанием запоров [6].
Для уточнения всех этих вопросов требуется дальнейшее изучение влияния различных групп психотропных медикаментов на клинические проявления и течение СРК. Применение этих препаратов представляется сегодня достаточно перспективным с учетом следующих обстоятельств.
Во-первых, у подавляющего большинства пациентов с СРК отмечаются коморбидные психические заболевания (чаще всего невротического уровня) различной степени тяжести. Среди больных с рефрактерным течением СРК психоневрологические отклонения отмечаются в 98 % случаев [6, 20]. Поскольку медицинский профессионализм требует комплексного психосоматического подхода к каждому пациенту, разделять невротические изменения и клинические проявления СРК нецелесообразно. Это единая патологическая система, требующая адекватной комплексной терапии.
Во-вторых, хорошо зарекомендовавшая себя при рефрактерном течении СРК гипнотерапия [16, 19, 22] в России используется ограниченно, прежде всего – из-за отсутствия специалистов, занимающихся этой методикой.
Большие надежды возлагались на ряд лекарственных средств, создававшихся специально с целью лечения СРК. Это группа препаратов, воздействующих на серотониновые 5HT-рецепторы. Первым среди препаратов этой группы стал алосетрон, затем на фармацевтическом рынке появились тегасерод и прукалоприд, однако их применение в настоящее время ограниченно из-за побочных эффектов, в основном со стороны сердечно-сосудистой системы, которые, как показал ряд исследований, возможно, присущи препаратам этой группы [21]. Алосетрон был позднее одобрен FDA для применения пациентами с СРК, однако в России он не зарегистрирован. Прукалоприд был усовершенствован путем повышения тропности к 5HT4-рецепторам, и в настоящее время это единственный препарат данной группы, разрешенный к применению на территории Российской Федерации. Он может использоваться пациентами, страдающими СРК с преобладанием запоров, т. к. основной его эффект – усиление кишечной моторики.
Таким образом, психотропные препараты, в первую очередь антидепрессанты и нейролептики, – это средства, на сегодняшний день доступные и имеющие подтвержденную эффективность среди пациентов с рефрактерным течением СРК, особенно при коморбидности с различными психоневрологическими расстройствами. Дискутабельным остается вопрос выбора тех или иных препаратов при различных подтипах СРК (с преобладанием диареи или запоров), а также согласованности назначений гастроэнтерологов и психиатров, которые должны привлекаться к процессу лечения таких больных для обсуждения вопросов выбора препаратов, определения дозировок, длительности курса терапии.
Материал и методы
Мы обследовали 30 женщин с диагнозом СРК. Из них 16 (53,3 %) имели форму СРК с преобладанием запоров и 14 (46,7 %) форму с диареей. Возраст колебался от 20 до 60 лет, в среднем составив 39,5 ± 12,3 года. В исследование отбирались пациентки с рефрактерным течением заболевания, отмечавшие практически постоянное нарушение стула на протяжении последних 2 и более лет, частые выраженные боли в животе. Длительность заболевания в среднем составила 7,1 ± 2,6 года. Все больные до начала исследования по назначению специалистов принимали препараты, традиционно используемые в гастроэнтерологии: спазмолитики, антидиарейные препараты или слабительные средства, пре- и пробиотики. По данным проведенного опроса, эффект от перечисленной терапии либо отсутствовал (44 % пациенток), либо был непродолжительным (от 2 недель до 1,5 месяцев, после чего симптомы возобновлялись).
Лечение в клинике (Специализированная клиническая психоневрологическая больница № 8 – Клиника неврозов) назначалось с учетом ведущего психопатологического синдрома, т. к. все больные имели коморбидное психическое заболевание невротического уровня: 4 (13,3 %) из них – паническое расстройство, 21 (70 %) – смешанное тревожное и депрессивное расстройство, 2 (6,7 %) – недифференцируемое соматоформное и 3 (10 %) – ипохондрическое расстройства.
В соответствии с назначенной терапией все больные были разделены на 3 группы:
• 1-я группа – получавшие ТЦА (амитриптилин, пипофезин): 11 человек, из них 5 с преобладанием диареи и 6 с преобладанием запоров.
• 2-я группа – получавшие ТРЦА (мапротилин): 9 человек, из них 4 с преобладанием диареи и 5 – запоров.
• 3-я группа – получавшие антидепрессанты группы селективных ингибиторов обратного захвата серотонина (СИОЗС; флувоксамин):10 человек, из них 5 с преобладанием диареи и 5 – запоров.
Группы формировались методом случайной выборки.
Влияние терапии антидепрессантами на клинические проявления СРК оценивались следующим образом:
• Динамика абдоминального болевого синдрома (АБС) – с помощью визуально-аналоговой шкалы (ВАШ) и болевого опросника Мак–Гилла (MPQ) с учетом общего числа выбранных дескрипторов (ОЧВД) и рангового индекса боли (РИБ).
• Динамика нарушений кишечной моторики – путем учета частоты дефекаций и консистенции стула по Бристольской шкале форм кала.
• Изменение психоэмоционального состояния исследовалось с помощью Госпитальной шкалы тревоги и депрессии – Hospital Anxiety Depression Scale (HADS). Все исследования проводились при поступлении и на 21–28-й день госпитализации (в среднем 24,5 ± 2,4 дня).
Результаты и обсуждение
Динамика АБС во всех трех группах представлена в табл. 1–3.
Как следует из данных табл.1, под действием ТЦА (амитриптилина или пипофезина) отмечен регресс АБС к 21–28-му дню лечения, по значению сопоставимый в обеих подгруппах (СРК с преобладанием запоров и диареи).
Среднее значение выраженности АБС в 1-й группе до лечения, по данным ВАШ, исходно составляло 5,2 ± 2,0 см, на 21–28-й день лечения – 3,0 ± 1,4 см. По данным MPQ, среднее значение ОЧВД до лечения составляло 17,3 ± 4,1, после лечения – 4,5 ± 2,1; РИБ – 19,3 ± 6,9 и 10,0 ± 4,2 соответственно.
Среди пациентов 2-й группы, получавших ТРЦА мапротилин, отмечено снижение выраженности АБС по ВАШ с 4,3 ± 1,7 до 2,4 ± 1,3 см. ОЧВД понизилось с 9,1 ± 3,2 до 3,9 ± 1,3, а РИБ – с 12,8 ± 4,5 до 5,6 ± 2,8 (табл. 2). В подгруппе СРК с преобладанием диареи положительная динамика была более выраженной, чем в подгруппе с преобладанием запоров.
В 3-й группе больных, получавших СИОЗС флувоксамин, отмечен регресс абдоминального болевого синдрома со следующими показателями: среднее значение ВАШ в результате лечения снизилось с 3,5 ± 1,4 до 1,7 ± 0,8 см, ОЧВД – с 9,4 ± 4,1 до 4,0 ± 2,1 и РИБ – с 14,6 ± 6,9 до 5,3 ± 2,6 соответственно. Регресс АБС в подгруппе СРК с преобладанием запоров был более значительным, чем в подгруппе с преобладанием диареи.
Таким образом, положительная динамика клинических проявлений СРК в виде значительного регресса АБС отмечена среди пациенток всех трех группах, и хотя средние показатели оценки выраженности боли с помощью ВАШ и MPQ были достаточно близкими, достоверно более выраженная положительная динамика (p ≤ 0,05) отмечена в 3-й группе больных, получавших СИОЗС.
Следующим критерием оценки влияния антидепрессантов на клинические проявления СРК являлось исследование моторики кишечника. С этой целью проведена регистрация частоты и характера стула больных при поступлении и на фоне проводимой терапии (21–28-й день лечения). Консистенция стула оценивалась по Бристольской шкале форм кала.
Среди больных 1-й группы, в подгруппе с преобладанием диареи, отмечен стул от 3 до 5 раз в день. Средняя частота дефекаций при поступлении составила около 3 раз в день, после проведенного лечения – немногим более 1 раза в день. Консистенция стула при поступлении варьировалась от 6-го до 7-го типа. На фоне лечения (21–28-й день терапии) у пациенток отмечен 3-6-й типы стула (рис. 1).
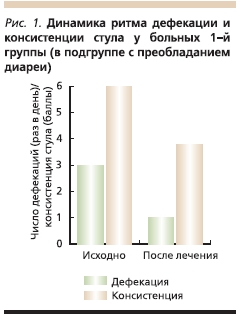
У больных 1-й группы, в подгруппе с преобладанием запоров, при поступлении частота стула составляла 1 раз в 3–5 дней (в среднем 1 раз в 4 дня), после лечения ТЦА частота дефекаций варьировалась от ежедневной (1 раз в день) до 1 раза в 4 дня (в среднем 1 раз в 3,2 дня). До лечения у пациенток отмечался 1–2-й типы стула, на фоне терапии – 1–4-й типы (рис. 2).
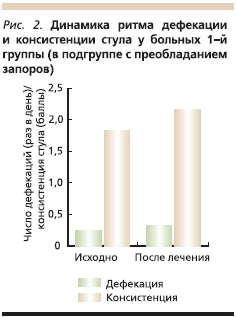
Во 2-й группе у пациентов с диареей до лечения частота дефекации составляла от 3 до 5 раз в день (в среднем 3,2 раза). После лечения частота стула варьировалась от 1 раза в день до 1 раза в 3 дня (в среднем 1,4 раза в день). Консистенция стула также изменилась: с 6–7-го типов на 2–4-й (рис. 3).
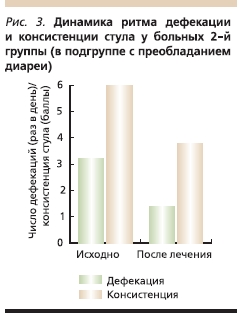
В подгруппе с преобладанием запоров дефекация отмечена 1 раз в 3–4 дня (в среднем 1 раз в 3,4 дня). На фоне проводимой терапии частота стула варьировалась от 2 раз в день до 1 раза в 3 дня (в среднем 1 раз в 2,2 дня). Консистенция стула до лечения была 1–3-го типов, после лечения – 2–4-го (рис. 4).
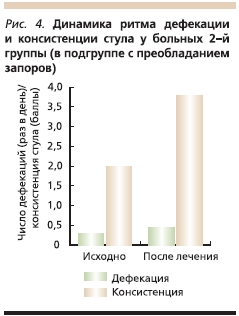
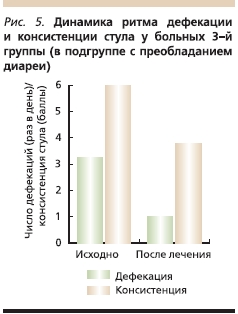
В 3-й группе у пациенток с СРК с преобладанием диареи стул до лечения был от 2 до 5 раз в день (в среднем 3,3 раза). На фоне лечения флувоксамином (на 21–28-й день терапии) частота стула составляла от 2 раз в день до 1 раза в 2 дня (в среднем 1 раз в сутки). Консистенция стула изменилась в результате лечения с 5–6-го на 2–5-й типы (рис. 5).
В подгруппе СРК с преобладанием запоров до лечения частота стула составляла от 1 раза в 2 дня до 1 раза в 6 дней (в среднем 1 раз в 3,7 дня), а после лечения – от 1 раза в день до 1 раза в 3 дня (в среднем 1 раз в 1,8 дня). Консистенция стула до лечения варьировалась от 1-го до 3-го типа, а после терапии была 1–4-го типов (в среднем ближе к 3-му типу по Бристольской шкале; рис. 6).
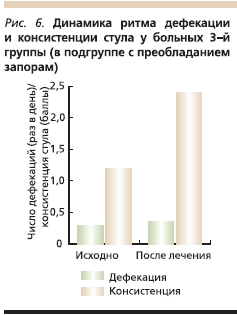
Таким образом, положительная динамика в отношении ритма дефекации и консистенции стула у больных СРК отмечена во всех трех группах, однако наиболее оптимальные результаты были достигнуты в 3-й группе, а самая незначительная динамика отмечена у пациенток 1-й группе, особенно в подгруппе с преобладанием запоров.
Исследование психоэмоционального состояния проводилось для полноты оценки общего статуса больных СРК с коморбидными невротическими расстройствами. С этой целью использовалась Госпитальная шкала тревоги и депрессии (HADS), одна из наиболее часто применяемых в мировой клинической психиатрии оценочных шкал.
Значения уровня тревоги и депрессии от 0 до 7 баллов следует расценивать как норму, от 8 до10 баллов – как субклинически выраженную тревогу и депрессию, больше 11 баллов – как клинически выраженные состояния.
В 1-й группе уровень тревоги имел клиническую выраженность, и под действием ТЦА отмечена нормализация данного показателя к 21–28-му дню терапии. Уровень депрессии был ниже субклинического значения, что связано с особенностями коморбидной психической патологии в данной группе, и его динамика не имеет существенного значения для оценки результатов лечения (табл. 4).
Во 2-й группе отмечены субклинические уровни тревоги и депрессии с нормализацией их показателей в обеих подгруппах на фоне лечения ТРЦА мапротилином (табл. 5).
В 3-й группе, в подгруппе с диареей, имелся клинически выраженный уровень тревоги до лечения, который опустился до субклинического значения на фоне проводимой терапии. Уровень депрессии был субклиническим, и на фоне проводимого лечения отмечена его нормализация. В подгруппе с запорами тревога и депрессия были выражены субклинически и после терапии флувоксамином отмечена нормализация обоих показателей.
Таким образом, параллельно с динамикой клинических проявлений СРК при лечении антидепрессантами во всех группах присутствовал значительный регресс уровней тревоги и депрессии.
Препараты применялись в дозировках в 2–4 раза ниже средних, рекомендуемых в клинической психиатрии, с учетом невротического уровня психической патологии. Побочных эффектов, которые могли бы потребовать отмены назначенных медикаментов, у больных, участвовавших в исследовании, не отмечено.
Следует также подчеркнуть, что в подгруппах с преобладанием запоров на фоне лечения не выявлено усиления констипации. Наоборот, во 2-й и 3-й группах присутствовала положительная динамика, в 1-й также имела место тенденция к улучшению в отношении частоты и консистенции стула, однако с учетом небольшой выборки больных для более глобальных выводов требуется дополнительное исследование с большим числом пациентов.
Выводы
1. Применение антидепрессантов групп ТЦА, ТРЦА и СИОЗС оказывает положительное влияние на состояние больных с рефрактерным течением СРК; отмечается значительный регресс АБС у пациентов как с диареей, так и с запорами. Более выраженный эффект антидепрессанты оказывают на диарейный синдром, однако препараты групп ТРЦА и СИОЗС также положительно влияют на частоту и консистенцию стула у пациентов с констипацией.
2. Антидепрессанты всех трех групп положительно влияют на психоэмоциональное состояние больных с тревожными депрессивными ипохондрическими расстройствами, паническими атаками и соматоформными нарушениями, снижая уровень тревожности и уменьшая выраженность депрессивных проявлений. Прослеживается связь между уменьшением выраженности АБС, тенденцией к нормализации стула и положительными изменениями в психическом статусе больных с рефрактерным течением СРК.
3. Отмечена хорошая переносимость лечения антидепрессантами всех трех групп, что безусловно связано с индивидуальным подбором, который во всех случаях были ниже средних терапевтических, стандартно используемых в клинической психиатрии.
Таким образом, антидепрессанты являются препаратами, способными оказывать выраженное положительное влияние на клинические проявления СРК у пациентов с рефрактерным течением данного заболевания. Для оптимизации лечения таких больных оно должно проводиться совместно гастроэнтерологами и психиатрами. Для уточнения вопроса подбора класса антидепрессантов для пациентов с различными субтипами СРК (с диареей или запором) требуются дальнейшие исследования в данном направлении.



