Актуальность
Острые респираторные инфекции представляют приоритетную социально-экономическую проблему, поскольку занимают лидирующее положение, составив до 90% всей регистрируемой инфекционной патологии у детей [1, 2]. Внебольничные пневмонии (ВП) остаются одной из основных причин заболеваемости, госпитализации и смертности как в развивающихся, так и в индустриально развитых странах [3]. При прогнозировании течения и исходов пневмонии важна своевременная диагностика «критического» развития бактериального воспалительного процесса, что определяется не только клинико-рентгенологической характеристикой, но и лабораторными показателями (число лейкоцитов, палочкоядерный сдвиг, определение уровней С-реактивного белка, серомукоида в крови и др.) [4, 5]. Одним из современных методов диагностики, вошедших в стандарты оказания медицинской помощи больным пневмонией, является определение прокальцитонина – предиктора бактериальной инфекции при показателе ≥0,5 нг/мл [6, 7].
Основной предотвратимой причиной ВП служит пневмококк [8, 9]. Исследования зарубежных авторов показали, что не менее 75% инвазивных пневмококковых инфекций связаны с 11 серогруппами Streptococcus pneumonia [10, 11]. С учетом дополнений в Национальный календарь прививок в России в педиатрической практике рекомендуется использовать 13-валентную конъюгированную пневмококковую вакцину (ПКВ-13). Имеются немногочисленные данные об эффективности пневмококковой вакцины в регионах.
Цель исследования: определить преморбидные, клинические факторы риска и лабораторные предикторы развития тяжелых пневмоний у детей; оценить влияние вакцинации против пневмококка на заболеваемость ВП у детей в Пензе.
Методы
Дизайн исследования включает три раздела: первый – определение преморбидных, клинических факторов риска тяжелых пневмоний. Под наблюдением находились 30 пациентов в возрасте от 1 месяца до 5 лет (36 мальчиков, 20 девочек), поступивших на стационарное лечение в областную детскую клиническую больницу (стационар) в тяжелом состоянии и нуждавшихся в лечении в условиях отделения реанимации и интенсивной терапии (ОРИТ). Всем больным проводили стандартные клинико-лабораторные и инструментальные (в т.ч. рентгенологические) исследования. Второй раздел – определение диагностической ценности теста на прокальцитонин (ПКТ). Под наблюдением находились 26 пациентов различной степени тяжести, у которых определяли концентрацию ПКТ плазмы. Третий раздел – определение эффективности применения ПКВ-13 в профилактике пневмококковой ВП.
Критерии соответствия:
- 1-й раздел – критерии включения: дети с тяжелой пневмонией, находящиеся на лечении в ОРИТ;
- 2-й раздел – критерии включения: дети с диагностированной пневмонией и проведенным исследованием ПКТ в плазме крови;
- 3-й раздел – критерии включения: дети, не имеющие острых и обострения хронических заболеваний; письменное согласие родителей на вакцинацию.
Набор пациентов для 1-го и 2-го разделов исследования проведен на базе ГБУЗ «Пензенская областная детская клиническая больница им. Н.Ф. Филатова» в течение года. Набор пациентов для 3-го раздела исследования проведен на базе ГБУЗ «Городская детская поликлиника Пензы». Использованы данные эпидемиологической службы по заболеваемости ВП за 2011–2016 гг.
Определение концентрации ПКТ плазмы проведено иммунохроматографическим методом (диагностический набор «Прокальцитонин–экспресс-тест» производства компании B.R.A.H.M.S., Германия) для полуколичественного определения ПКТ, предел обнаружения составил 0,5 нг/мл.
Для вакцинации детей в соответствии с Национальным календарем прививок использован ПКВ-13. Использована схема для массовой иммунизации детей: 2 дозы с интервалом не менее 8 недель между введениями. Ревакцинация однократно в 11–15 месяцев. Вакцинация детей в возрасте 7–11 месяцев проведена по схеме 2 дозы с интервалом не менее 4 недель между введениями и ревакцинация однократно на втором году жизни. Критерии включения: дети, не имевшие острых и обострения хронических заболеваний; письменное согласие родителей на вакцинацию.
Конечная точка 1-го раздела исследования – показатели дыхательной недостаточности (ДН), сердечно-сосудистой недостаточности и состояние сознания; конечная точка 2-го раздела исследования – выраженность воспалительного процесса; исход исследования 3-го раздела – эффективность вакцинопрофилактики пневмококковых ВП.
Дополнительные исходы исследования. Неприменимо.
Анализ в подгруппах. 1-й раздел – под наблюдением находились 30 пациентов в возрасте от 1 месяца до 3 лет (7 девочек, 23 мальчика), поступивших в стационар в тяжелом состоянии с клиникой пневмонии и нуждавшихся в лечении в условиях ОРИТ. Пациенты были распределены в 2 группы. 1-я группа – 6 человек с тяжелыми врожденными и генетическими заболеваниями (врожденный порок сердца, болезнь Дауна, дегенеративное заболевание нервной системы, врожденные пороки развития, детский церебральный паралич), средний возраст – 16,6±9,3 месяца; 2-я группа – 24 ребенка с тяжелым течением пневмонии на фоне обструкции дыхательных путей за счет сопутствующего стенозирующего ларинготрахеита или бронхообструктивного синдрома, средний возраст – 10,1±7,8 месяца.
Второй раздел – под наблюдением находились 26 пациентов с ВП в возрасте 1 месяца до 5 лет (13 мальчиков, 13 девочек), поступивших на стационарное лечение в областную детскую клиническую больницу. Четырнадцать (53,8%) детей были госпитализированы из районов и районных центров, 12 (46,2%) – из областного центра. Все пациенты с положительными результатами теста по уровню ПКТ в плазме были распределены в 3 группы: 1-я группа – 6 (23,1%) детей с показателями ПКТ в плазме ≥0,5 нг/мл, но <2 нг/мл; 2-я группа – 2 (7,7%) ребенка с показателями ПКТ ≥2 нг/мл, но <10 нг/мл; 3-я группа – 2 (7,7%) пациента с уровнем ПКТ ≥10 нг/мл.
Третий раздел – сплошная выборка детей областного центра, получивших пневмококковую вакцину.
Всем больным проведены стандартные клинико-лабораторные и инструментальные (в т.ч. рентгенологические) исследования.
Этическая экспертиза. Неприменимо.
Полученные цифровые данные обработаны методами математического анализа, согласно законам медицинской статистики и с использованием персонального компьютера типа IBM AT-486 (программа- EXCEL-5,0) с определением средних величин показателей (М), расчетом стандартных ошибок средних величин этих показателей (м), выявлением достоверности различий средних значений показателей в сравниваемых группах с использованием t-критерия Стъюдента. Различия оценивались как достоверные при вероятности 95% (p<0,05) и выше.
Проведен статистический анализ заболеваемости ВП детей в возрасте до 17 лет в 2011–2016 гг. в Пензе по результатам статистического учета ВП.
Результаты исследования
Проанализированы истории болезни 56 детей, поступивших в стационар с клиникой пневмонии; медицинские карты детей, подведомственных ГБУЗ «Городская детская поликлиника» и получивших вакцинацию против пневмококка, статистические базы данных ГБУЗ «Городская детская поликлиника».
1. Проведен анализ преморбидных факторов и клинических симптомов, определивших тяжесть ВП у 30 пациентов в возрасте от 1 месяца до 3 лет (7 девочек, 23 мальчика), поступивших в стационар в тяжелом состоянии и нуждавшихся в лечении в условиях ОРИТ. Пациенты группы наблюдения были распределены в 2 подгруппы: 1-я подгруппа – 6 человек с тяжелыми врожденными и генетическими заболеваниями (врожденный порок сердца, болезнь Дауна, дегенеративное заболевание нервной системы, врожденные пороки развития, детский церебральный паралич), средний возраст – 16,6±9,3 месяца; 2-я подгруппа – 24 ребенка с тяжелым течением пневмонии на фоне обструкции дыхательных путей за счет сопутствующего стенозирующего ларинготрахеита или бронхообструктивного синдрома, средний возраст – 10,1±7,8 месяца. В 1-й подгруппе только 16,7% детей заболели остро с признаками вирусной инфекции, во 2-й у 62,5% пациентов заболевание сопровождалось симптомами вирусной инфекции с присоединением обструкции дыхательных путей и бактериального поражения легких (p<0,05). Продолжительность догоспитального этапа лечения в 1-й подгруппе составила 2,3±0,9 дня, во 2-й – 2,4±1,3 (p>0,05), госпитального этапа – 34,0±10,6 и 18,3±5,7 дня (p<0,05); длительность интенсивной терапии в ОРИТ – 19,0±8,0 и 6,0±3,8 дня (p<0,05) соответственно. Тяжесть состояния была обусловлена синдромом ДН, который преобладал во 2-й подгруппе (во 2-й подгруппе ДН III выявлена у 37,5%, в 1-й – у 16,7%, ДН II – у 58,3 и 83,3% соответственно; p<0,05), а также нарушением кровообращения (НК), которое преобладало в 1-й подгруппе (НК II в 1-й подгруппе – у 83,3%, во 2-й – у 37,5%; p<0,05). Острое токсико-гипоксическое поражение центральной нервной системы (ЦНС) отмечено в 1-й подгруппе у 33,3%, во 2-й – у 8,3% (p<0,05). Очагово-сливной характер поражения легочной ткани в 1-й подгруппе отмечен у 66,7%, во 2-й – у 20,8% больных. При изучении факторов риска тяжелого течения пневмонии во 2-й подгруппе выявлены сочетания нескольких факторов риска у 75% детей, в т.ч. тимомегалия – у 37,5%, анемия – у 45,8%, церебральная ишемия – у 29,2%, паратрофия – у 25%, недоношенность – у 29,2%, ателектатическая пневмония недоношенных – у 16,7%, отягощенный акушерский анамнез матерей (гестоз, угроза прерывания беременности, кесарево сечение, анемия) – у 45,8%, аллергическая аномалия конституции – у 29,2%, 25% детей отнесены к группе часто болеющих.
2. При анализе клинических особенностей пневмонии у 26 пациентов с ВП в возрасте от 1 месяца до 5 лет (13 мальчиков, 13 девочек), поступивших на стационарное лечение в областную детскую клиническую больницу, выявлено, что у 18 (69,2%) детей заболевание начиналось с признаков вирусной инфекции и выраженного катарального синдрома, у 8 (30,8%) детей – с малопродуктивного кашля; повышение температуры отмечено у 24 (92,3%) больных. Состояние 16 (61,5%) пациентов при поступлении было расценено как тяжелое за счет симптомов интоксикации и признаков ДН, развившейся на фоне бронхообструктивного синдрома у 9 (34,6%) больных, у 3 (11,5%) детей – вследствие распространенного воспалительного процесса в легких, осложненного экссудативным плевритом и/или деструкцией легочной ткани. В то же время воспалительные изменения в клиническом анализе крови (лейкоцитоз более 10,0×109/л, СОЭ более 12 мм/ч) выявлены лишь у 15 (57,7%) пациентов. Всем больным проведен тест с определением ПКТ в сыворотке крови. Положительные результаты теста отмечены у 10 (38,5%) больных. При рутинных исследованиях крови только у 7 детей с повышенным уровнем ПКТ (≥0,5 нг/мл) выявлена высокая СОЭ, у 7 – лейкоцитоз; лейкопения (при высокой СОЭ) обнаружена у 1 ребенка. У 5 больных имело место повышение уровня С-реативного белка более 15 мг/л, показатели серомукоида не превышали 0,6 е.д. опт. плотности (за исключением одного случая с деструктивной пневмонией – 1,1 е.д. опт. плотности). Среди 10 пациентов с повышенным уровнем ПКТ только у 5 при поступлении состояние было расценено как тяжелое. Все пациенты с положительными результатами теста по уровню ПКТ в плазме были распределены в 3 группы: 1-я группа – 6 (23,1%) детей с показателями ПКТ в плазме ≥0,5 нг/мл, но <2 нг/мл; 2-я – 2 (7,7%) ребенка с показателями ПКТ ≥2 нг/мл, но <10 нг/мл; 3-я группа – 2 (7,7%) пациента с уровнем ПКТ ≥10 нг/мл. В 1-й группе у 5 детей отмечен короткий период амбулаторного лечения (1–2 дня), раннее начало адекватной антимикробной терапии, а воспалительный процесс в легких носил очаговый характер. У одного пациента, поступившего на 5-е сутки от начала заболевания, выявлены левосторонняя нижнедолевая очаговая пневмония с поражением нескольких сегментов легкого, отсутствие лейкоцитоза, положительные показатели ПКТ≥0,5 нг/мл, но <2 нг/мл (тест проведен на 5-е сутки от начала антибактериальной терапии).
У пациентов 2-й группы в одном случае отмечены распространенный очагово-сливной процесс в верхней и средней долях правого легкого, средняя степень тяжести заболевания, лейкоцитоз 16,0×109/л, во втором случае диагностирована очаговая пневмония, осложненная левосторонним средним отитом. Показатели ПКТ более 10 нг/мл (3-я группа) обнаружены у двух больных деструктивным процессом в легких, развитием синдрома системной воспалительной реакции, признаками генерализации процесса с поздней госпитализацией (на 6–7-й день болезни) и отсутствием своевременной антибактериальной терапии.
В одном случае этиологически верифицирован листериоз (из бронхов и плевральной полости выделена Listeria monocitogenes), висцеральная форма с преобладающим деструктивным процессом в легких, осложненным гнойным экссудативным плевритом, ателектазом нижней доли правого легкого, выраженными клинико-лабораторными проявлениями системной воспалительной реакции и полиорганной недостаточности. У второго пациента диагностирован тяжелый сепсис с множественными гнойными очагами (очагово-сливная пневмония, гнойный плеврит, гнойный перикардит – оперативное лечение). Все пациенты выписаны из стационара с выздоровлением.
3. Показатель заболеваемости ВП в период с 2011 по 2016 г. у детей в возрасте от 0 до 17 лет находится в интервале от 703,9 на 100 тыс. населения (2011) до 1165,9 на 100 тыс. населения (2016) с тенденцией роста. За 6-летний период наблюдения отмечено 2 пика заболеваемости: в 2012 и 2016 гг.
Заболеваемость ВП среди детского населения Пензы за 2011–2016 гг. представлена в табл. 1.
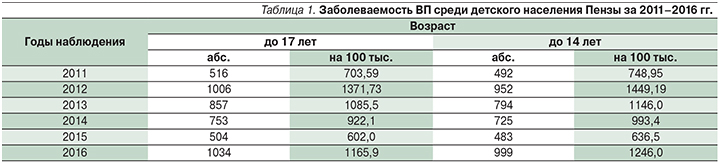
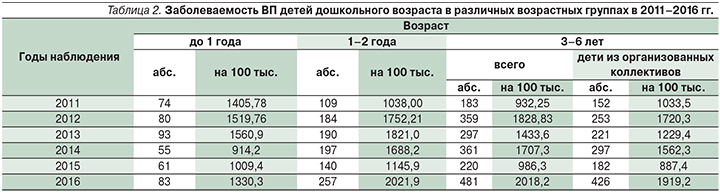
Анализ полученных данных показал, что самый высокий уровень заболеваемости ВП выявлен у детей в возрасте от 1 года до 2 лет и составил 1405,78 на 100 тыс. детского населения в 2011 г. и 2021,9 на 100 тыс. в 2016 г. Также высокой была заболеваемость ВП у детей в возрасте от 3 до 6 лет – 932,25 и 2018,2 на 100 тыс. в 2011 и 2016 г. соответственно (табл. 2).
Проведение массовой вакцинопрофилактики пневмококковой инфекции в Пензенской области началось в 2011 г. и продолжается до настоящего времени. Повозрастное число детей, получивших полный курс вакцинации против пневмококковой инфекции (3 прививки), представлен в табл. 3, из которой видно, в что в 2015 и 2016 гг. 13-валентную полисахаридную конъюгированную адсорбированную вакцину для профилактики пневмококковой инфекции получили 5215 детей 2014 г. рождения и 4373 детей 2015 г. рождения, что составило 69,7 и 79,7% соответственно от численности детского населения Пензы этой возрастной группы (при рекомендуемом охвате прививками не менее 95%) (табл. 3).

Отмечено снижение на 10,2% числа привитых против пневмококковой инфекции детей 2015 г. рождения, что связано с перебоями поставки вакцины. Данный факт мог стать причиной роста заболеваемости ВП в 2016 г. по сравнению с 2014 г.
Был проведен сравнительный анализ заболеваемости ВП у привитых и непривитых детей. Выявлено, что показатель заболеваемости ВП у детей, привитых ПКВ-13, был в 3,2 раза ниже, чем у непривитых пациентов, и составил 740,4 и 2368,9 на 100 тыс. соответственно.
Побочные эффекты отсутствовали.
Обсуждение
Группа пациентов с пневмониями, нуждающихся в интенсивной терапии в ОРИТ, неоднородна (по характеру сочетанной патологии, факторам риска, степени выраженности синдромов ДН, НК, токсико-гипоксического поражения ЦНС), что влияет на прогноз течения заболевания, характер терапии и сроки пребывания в ОРИТ.
Тест с ПКТ – важный предиктор тяжелого течения пневмонии и развития осложнений; наиболее информативен при легочной деструкции или формировании септического процесса.
Показатель заболеваемости ВП у детей, привитых ПКВ-13, ниже, чем у непривитых детей, в 3,2 раза.
Выявленная неоднородность группы пациентов с пневмониями, нуждающихся в интенсивной терапии в ОРИТ, определяет необходимость дифференцированного подхода к прогнозу течения заболевания, влияет на характер терапии основного заболевания и прогнозируемых осложнений. Прогностически наиболее неблагоприятным при тяжелой пневмонии служит наличие врожденных и генетических заболеваний с быстрым развитием у таких пациентов очагово-сливного процесса, синдрома ДН и токсико-гипоксического поражения ЦНС. При вирусно-бактериальных процессах течение пневмоний отягощает развитие бронхообструктивного синдрома у детей с сочетанием нескольких неблагоприятных факторов пре- и постнатального развития. Проведенные исследования подтверждают необходимость включения теста на определение уровня ПКТ в сыворотке крови в комплекс лабораторного обследования больных пневмонией. Тест с ПКТ (как предиктор бактериального воспаления) наиболее информативен при развитии сепсиса, а также при распространенном воспалительном процессе в легких, наличием внелегочных бактериальных осложнений и тяжелом течении заболевания. Определение уровня ПКТ в плазме целесообразно проводить в первые дни госпитализации пациентов при тяжелой степени клинических проявлений ВП и при позднем поступлении в стационар. При уровне ПКТ более 2 нг/мл необходим «поиск» бактериальных осложнений; показатели ПКТ более 10 нг/мл свидетельствуют о развитии легочной деструкции или формировании септического (генерализованного) процесса (в т.ч. с множественными гнойно-воспалительными очагами). Выявлена прямая связь между заболеваемостью ВП и уровнем привитости детского контингента против пневмококка. Исследование проведено на большой когорте детей областного центра и подтверждает актуальность вакцинопрофилактики против пневмококка.
Заключение
К предикторам тяжелого течения ВП относятся сочетанные заболевания, наличие множественных преморбидных факторов риска, что позволяет с момента поступления ребенка в стационар оценить риск развития осложненного течения заболевания. Для своевременной диагностики «критических» состояний необходимо внедрение теста с ПКТ в комплексное обследование каждого пациента группы риска по тяжелому течению пневмонии. Активное проведение национальной программы по вакцинопрофилактике пневмококковой инфекции позволит снизить заболеваемость ВП. В вакцинопрофилактике против пневмококка особенно нуждаются дети группы риска по тяжелому течению пневмонии.



